Piles, accumulateurs et piles à combustible
Rappels
Réactions d’oxydoréduction :
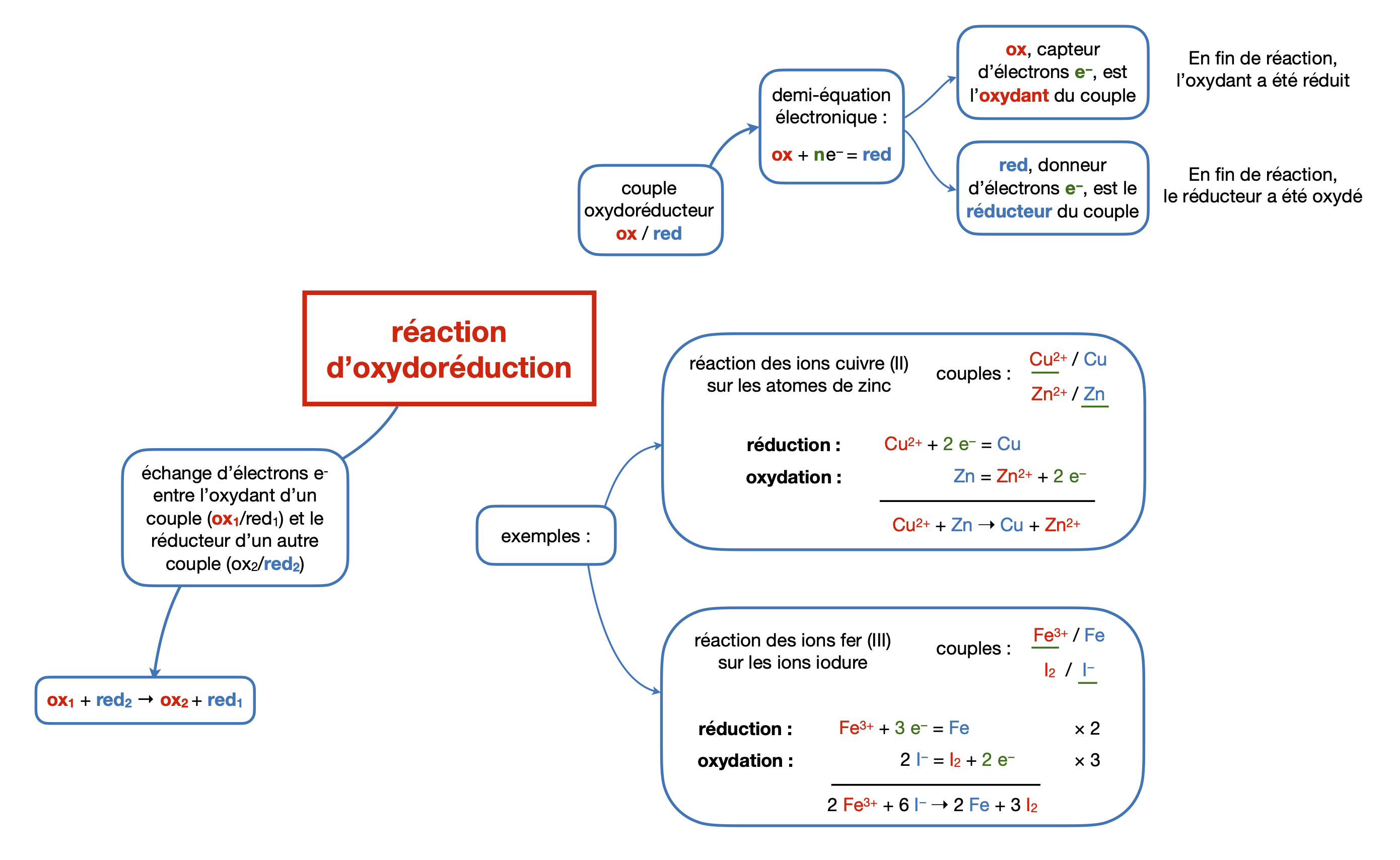
Il y a échanges d’électrons lors d’une réaction d’oxydoréduction (alors que ce sont des échanges de protons dans les réactions acidobasiques).
Savoir et savoir faire
Équilibrer les demi-équations redox
Déterminer une équation bilan à partir des demi-équations
Décrire ce qui se passe à chaque électrode pendant une décharge et pendant une charge
Lier une demi-équation à une électrode (cathode ou anode)
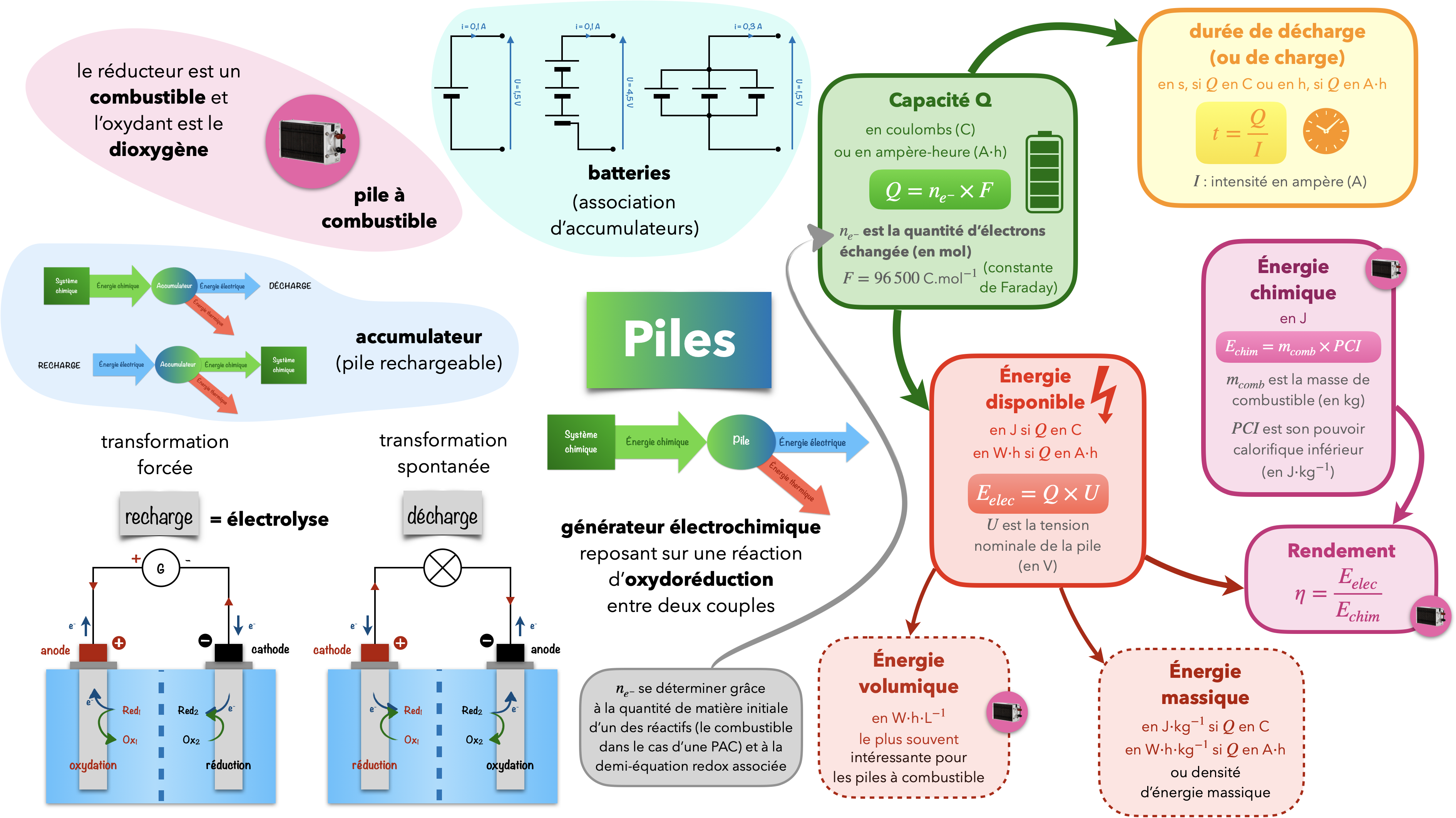
Différentier et définir une pile, un accumulateur et une batterie
Calculer l’énergie totale stockée
Exploiter les principales caractéristiques des piles ou accumulateurs (tension à vide, capacité, énergies massique et volumique, nombre de cycles de charge et décharge) pour les utiliser dans des applications spécifiques.
Une capacité $Q$ (la “charge”) (qui mesure la “quantité d’électricité” dans la pile) est souvent donnée en ampères-heures $\pu{A*h}$ ou milli ampères-heures $\pu{mA*h}$.
On convertit alors en coulombs en passant des heures aux secondes :
$\pu{1,0 A*h}=\pu{3,6E3 C}$
$\pu{1,0 mA*h}=\pu{3,6 C}$
Équilibrer les demi-éqautions redox peut nécessiter d’utiliser des ions $\ce{H+}$ ou $\ce{OH-}$ suivant le pH et des molécules d’eau $\ce{H2O}$.
Si c’est le cas, les demi-équations seront au minimum données précomplétées au bac 😅.
Cependant, il faut savoir que pour l’écriture des couples $\ce{(Ox/Red)}$, on ne prend en compte ni $\ce{H+}$, ni $\ce{OH-}$, ni $\ce{H2O}$.
Exemple :
Le couple correspondant à la demi-équation $\ce{NiOOH + H2O + e- = Ni(OH)2 + HO-}$ est $\ce{(NiOOH/Ni(OH)2)}$.
La tension nominale d’une pile est sa tension à vide (en circuit ouvert), aussi appelée f.e.m. (pour force électro motrice), lorsqu’elle est neuve.
Exercices :
- Sur l’oxydoréduction :
Lessive (extrait sujet 2022 métropole)
- Sur les piles :
Pile saline (extrait sujet 2023 Mayotte-Liban)
Pile à combustible (adapté du Livre Scolaire)
Robot d’assistance à la personne (extrait sujet 2022 Mayotte-Liban) – correction
Quiz
$\ce{PbO2 + 4 H+ + 2 e- = Pb^2+ + 2 H2O}$ - [ ] $n_{\ce{e-}} = \pu{0,5 mol}$
$n_\ce{Pb^2+} = \pu{1,0 mol}$ - [ ] $n_{\ce{e-}} = \pu{1,0 mol}$
$n_\ce{Pb^2+} = \pu{1,0 mol}$ - [x] $n_{\ce{e-}} = \pu{2,0 mol}$
$n_\ce{Pb^2+} = \pu{1,0 mol}$ ## Lors de la recharge d'une batterie au plomb à électrolyte acide :
$\ce{2 Pb^2+ + 2 H2O -> PbO2 + 4 H+ + Pb}$ - [ ] le pH de l'électrolyte augmente - [x] le pH de l'électrolyte diminue - [ ] il n'y a aucune incidence sur le pH de l'électrolyte ## L'équation bilan de fonctionnement d'une pile à hydrogène est : - [x] $\frac{1}{2} {\text{O}_2}_{\text{(g)}} + {\text{H}_2}_{\text{(g)}} \rightarrow {\text{H}_2\text{O}}_{\text{(l)}}$ - [ ] $\text{H}_2 = 2 \text{H}^+ + 2 \text{e}^-$ - [ ] $2 {\text{H}_2\text{O}}_{\text{(l)}} \rightarrow{\text{O}_2}_{\text{(g)}} + 4 \text{H}^+ + 4 \text{e}^-$ ## Bilan de matière pour 1,0 mol d'électrons dans :
$\ce{H_2 = 2 H+ + 2 e-}$ - [ ] $n_{\ce{H2}} = \pu{0,5 mol}$
$n_{\ce{H+}} = \pu{0,5 mol}$ - [ ] $n_{\ce{H2}} = \pu{1,0 mol}$
$n_{\ce{H+}} = \pu{2,0 mol}$ - [x] $n_{\ce{H2}} = \pu{0,5 mol}$
$n_{\ce{H+}} = \pu{1,0 mol}$ ## Une pile à hydrogène consomme 2,0 mol de dihydrogène :
$\ce{O2_{(g)} + 2 H2_{(g)} -> 2 H2O_{(l)}}$ - [x] elle consomme 1,0 mol de dioxygène - [x] elle produit 2,0 mol d'eau - [ ] elle consomme 2,0 mol de dioxygène ## Pour une quantité d'électricité échangée $Q=\pu{1,0 A * h}$ : - [ ] $n_{\ce{e-}} = \pu{96500 mol}$ - [ ] $n_{\ce{e-}} = \pu{1,0E-5 mol}$ - [x] $n_{\ce{e-}} = \pu{3,7E-2 mol}$ > $F = \pu{96500 C * mol-1}$ ## Le bilan de matière d'une pile à combustible dépend : - [ ] uniquement de sa durée d'utilisation - [ ] de la tension qu'elle délivre - [x] de l'énergie qu'elle a fournie