Force des acides et des bases
Documents
| TP | Force des acides |
|---|---|
| Indicateurs colorés | |
| Activités | Tau d'avancement et $K_\mathrm{a}$ + |
| Diagramme de distribution + | Exercices | Chou rouge |
| Acide butyrique | |
| Acidité d'un vin | |
| Eau de Javel et acide (partie A) | |
| Vidéo expérience | La fontaine d'ammoniac |
Définitions
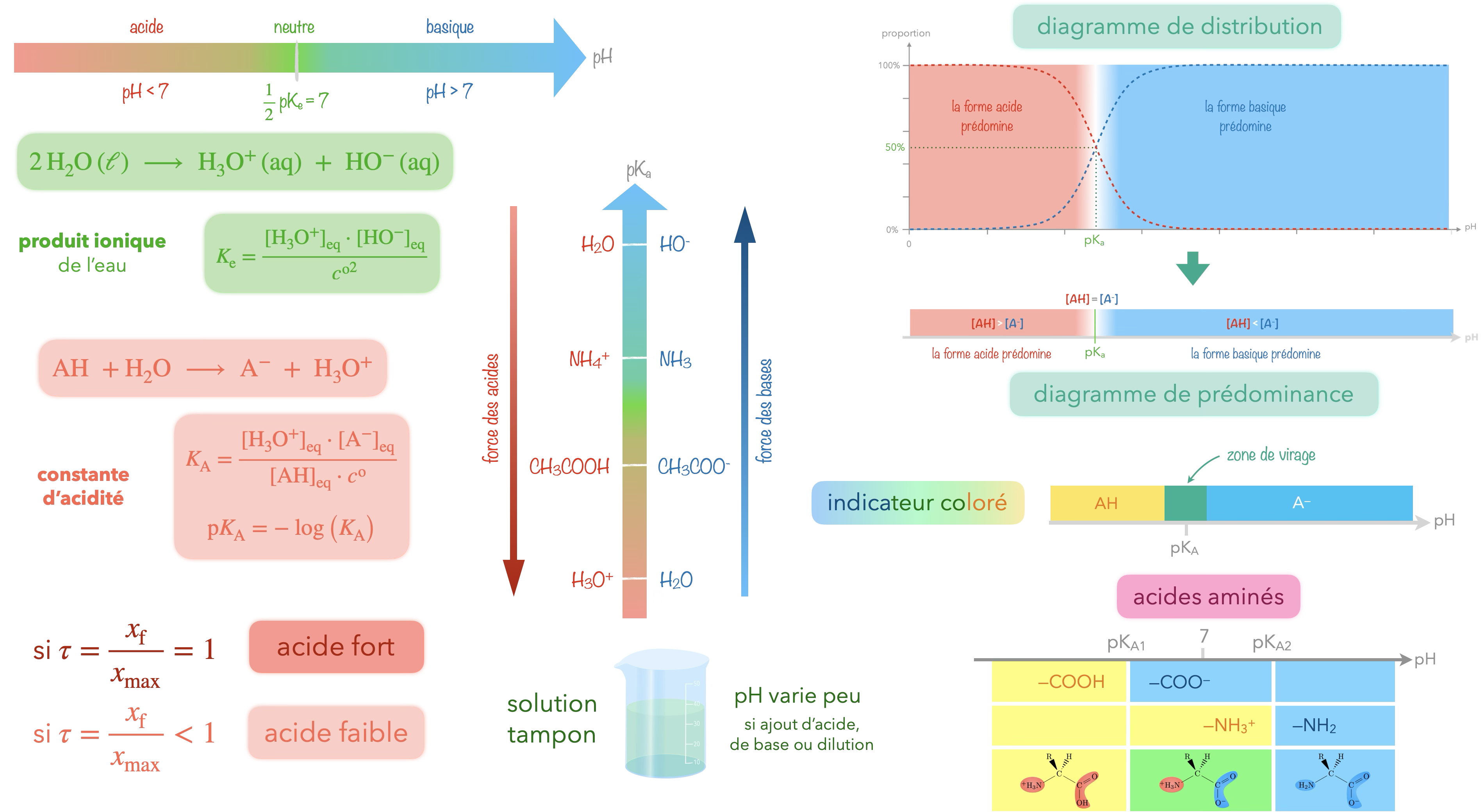
Un acide ou une base est dit fort(e) au sens de Brönsted dans l'eau si le taux d’avancement de la réaction modélisant son échange d’ion hydrogène avec l’eau est proche de 1.
La notion d’acide fort ou de base forte constitue un modèle introduit pour simplifier la détermination de la composition finale du système.
Exemple :
le chlorure d’hydrogène $\ce{HCℓ (g)}$ est un acide fort dans l’eau. Sa dissolution dans l’eau permet d’obtenir de l’acide chlorhydrique, solution modélisée par un mélange d’ions oxonium $\ce{H3O+ (aq)}$ et d’ions chlorure $\ce{Cℓ^- (aq)}$.
Constante d'acidité
Constante d’équilibre de la réaction entre un acide et l’eau, écrite avec un nombre stœchiométrique 1 pour l’espèce $\ce{H3O^+}$.
Cette grandeur est caractéristique d’un couple acide-base à une température donnée.
Exemple :
La constante d’acidité du couple acide éthanoïque/ion éthanoate est la constante d’équilibre de la réaction d’équation :
$\ce{CH3COOH(aq) + H2O(ℓ)\rightleftharpoons CH3COO^-(aq) + H3O^+(aq)}$