La température rend compte de l’agitation moléculaire.
La température absolue se mesure en kelvins $K$ $(\pu{0^\circ C = 273,15 K})$.
L’énergie interne $U$ d’un système se compose des énergies microscopiques cinétiques (agitation) et potentielles (interaction) des molécules qui le constituent.
La variation d’énergie interne $\Delta U = U_f - U_i$ d’un solide ou d’un liquide est donnée par la formule suivante :
$$\Delta U = m c \Delta\theta$$
où $m$ est la masse (en $\pu kg$) $c$ est la capacité thermique massique (en $\pu{ J * K-1 * kg-1}$) et $\Delta \theta = \theta_f - \theta_i$ est la variation de température (en $\pu K$ ou en $\pu{^\circ C}$)
Savoir et savoir faire
coeur
Décrire les liaisons hydrogènes responsables des liaisons intermoléculaires dans l’eau.
Lire et utiliser un diagramme d’état $(P,T)$ ; savoir déterminer l’état physique pour une pression et une température donnée et après une modification des paramètres.
Savoir si un changement d’état est exothermique ou endothermique.
Calculer une énergie de changement d’état à partir de l’énergie massique de changement d’état.
piege
L’évaporation est une vaporisation progressive qui a lieu à la surface d’un liquide (et non dans son volume). L’évaporation peut avoir lieu à des pressions et températures différentes de celles de la vaporisation.
piege
L’énergie massique de changement d’état est aussi appelée enthalpie massique de changement d’état et peut être notée $l$, ou $L$, ou $\Delta h$, ou $h$, ou encore $H$.
piege
Dans le langage courant, le terme condensation se substitue le plus souvent à liquéfaction et désigne alors le phénomène opposé à l’évaporation.
---
primary_color: steelblue
secondary_color: "#f2f2f2"
text_color: black
shuffle_questions: false
---
##
Les liaisons entre molécules d'eau s'appellent :
- [x] les liaisons hydrogène
- [ ] les liaisons aquatiques
- [ ] les liaisons oxygène
##
La solidification de l'eau est :
- [x] exothermique
- [ ] endothermique
- [ ] athermique
> exothermique : donne de la chaleur (énergie thermique) à l'extérieur ; endothermique : prend de la chaleur à l'extérieur
##
La vaporisation de l'eau est associée :
- [x] à une rupture des liaisons hydrogène entre molécules
- [ ] à la formation de liaisons hydrogène entre molécules
- [ ] au maintien de liaisons hydrogène entre molécules
##
Le nombre de laisions hydrogène entre molécules augmente pour :
- [x] la transition gaz $\rightarrow$ solide
- [ ] la transition liquide $\rightarrow$ gaz
- [ ] la transition solide $\rightarrow$ liquide
##
Dans le diagramme $(P,T)$ de l'eau :
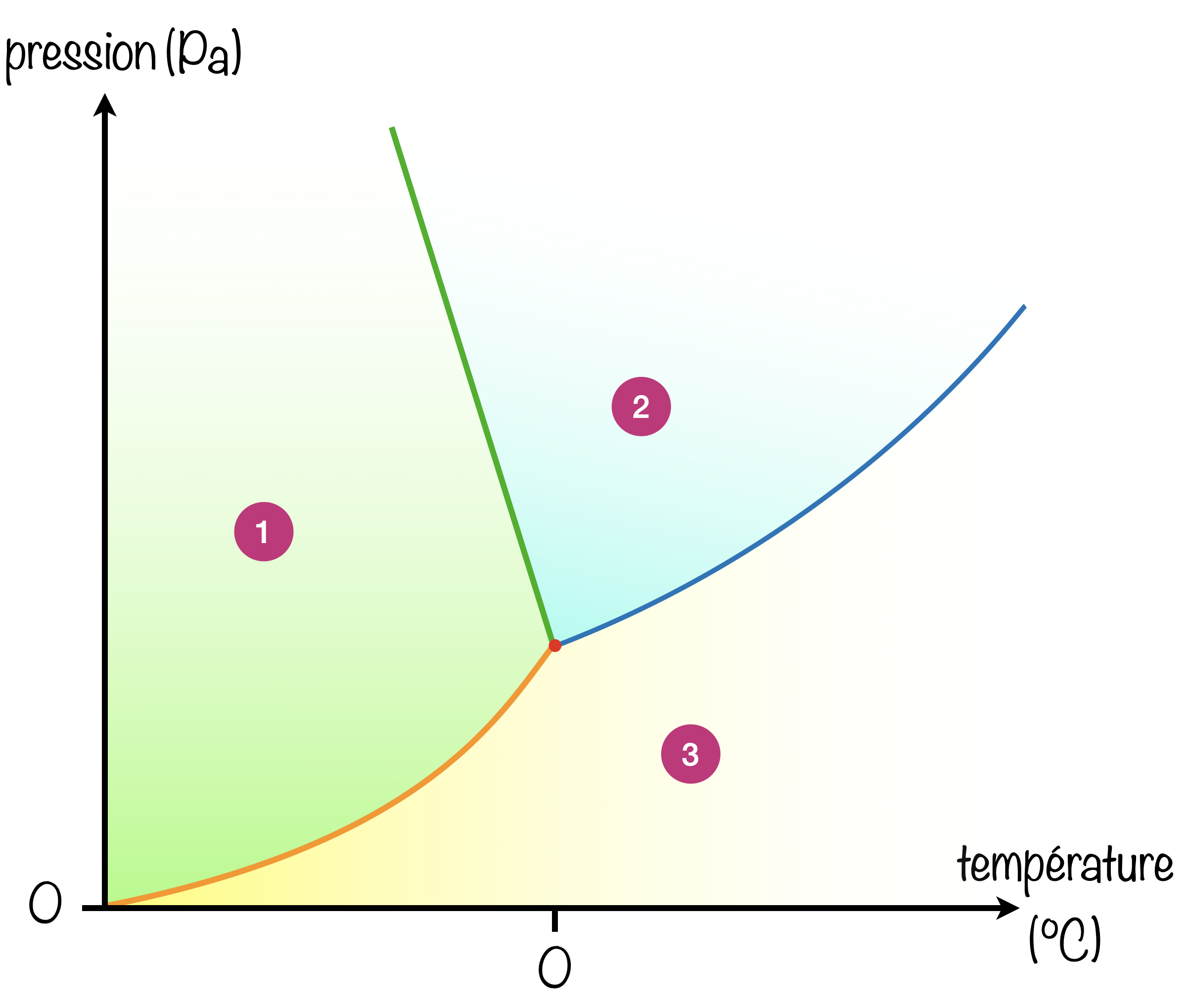
- [x] Le domaine de stabilité du solide correspond à la zone 1.
- [ ] Le domaine de stabilité du solide correspond à la zone 3.
- [x] Le domaine de stabilité du liquide correspond à la zone 2.
##
Dans le diagramme $(P,T)$ de l'eau :
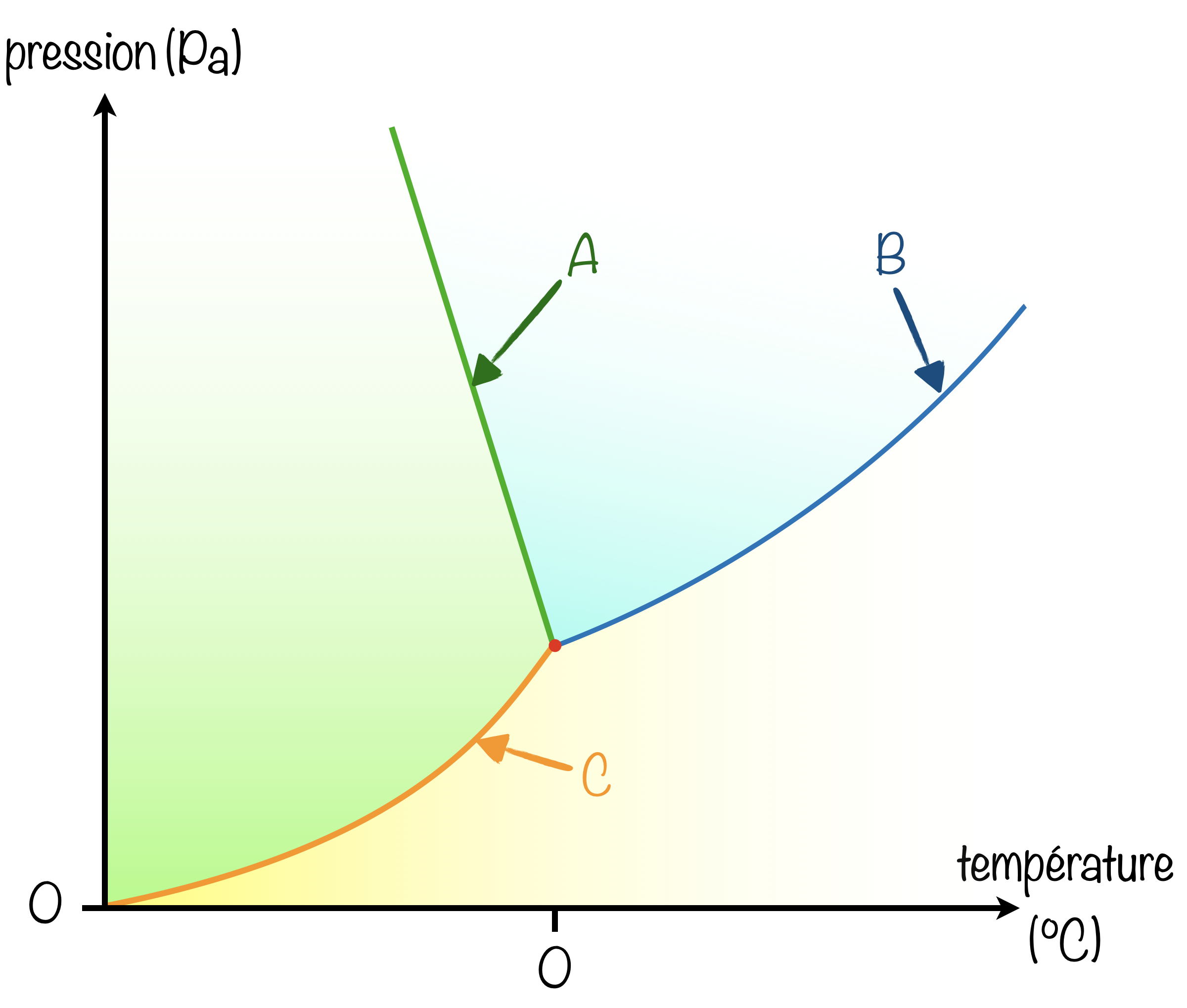
- [x] La courbe B correspond à la courbe de vaporisation.
- [x] La courbe A correspond à la courbe de fusion.
- [x] La courbe C correspond à la courbe de sublimation.
##
Dans le diagramme $(P,T)$ de l'eau :
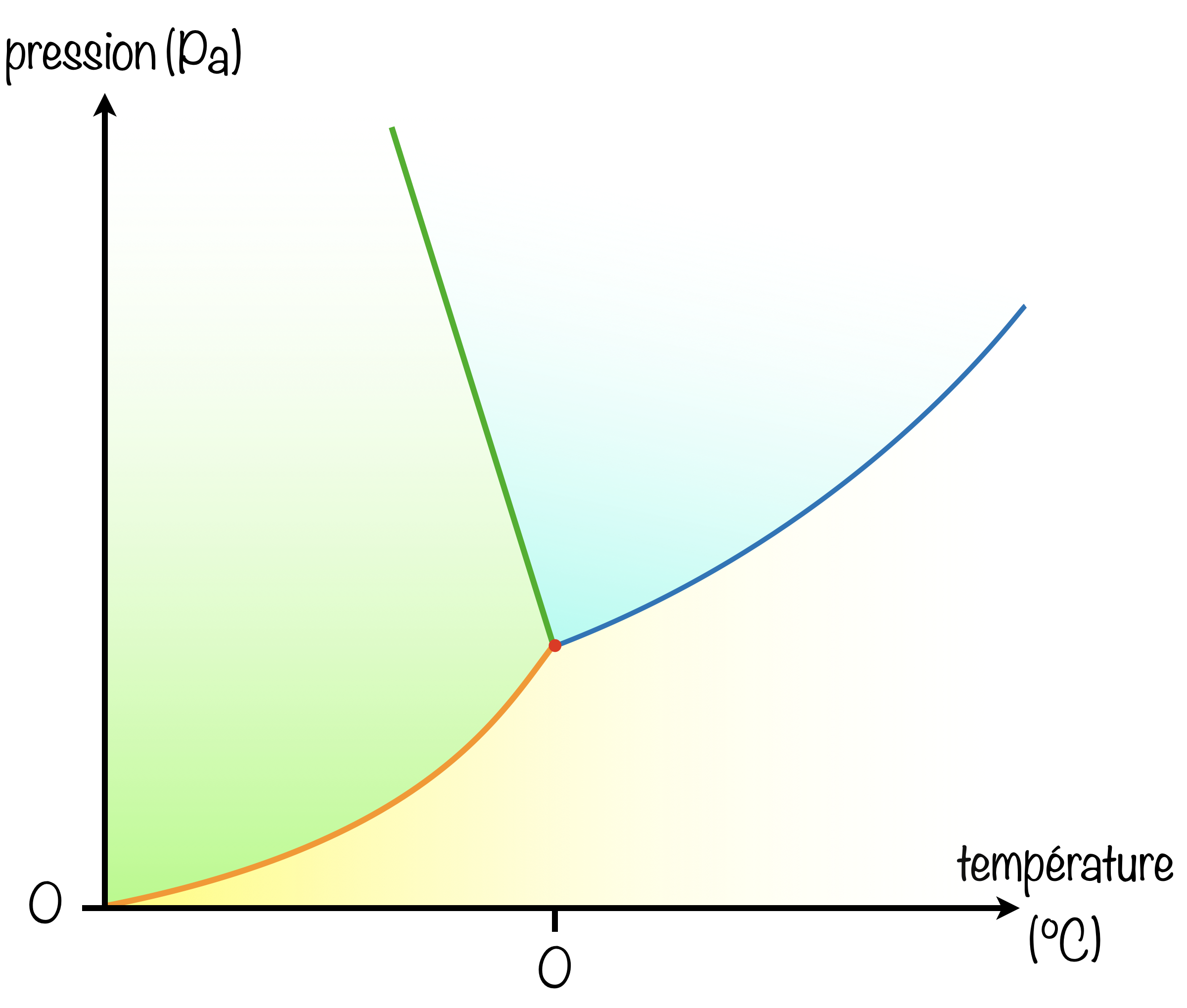
- [x] L'intersection des 3 courbes définit le point triple.
- [ ] L'intersection des 3 courbes définit l'origine du graphique.
- [x] Il existe un seul point où les phases solide, liquide et gazeuse existent ensemble.
##
Dans le diagramme $(P,T)$ de l'eau :
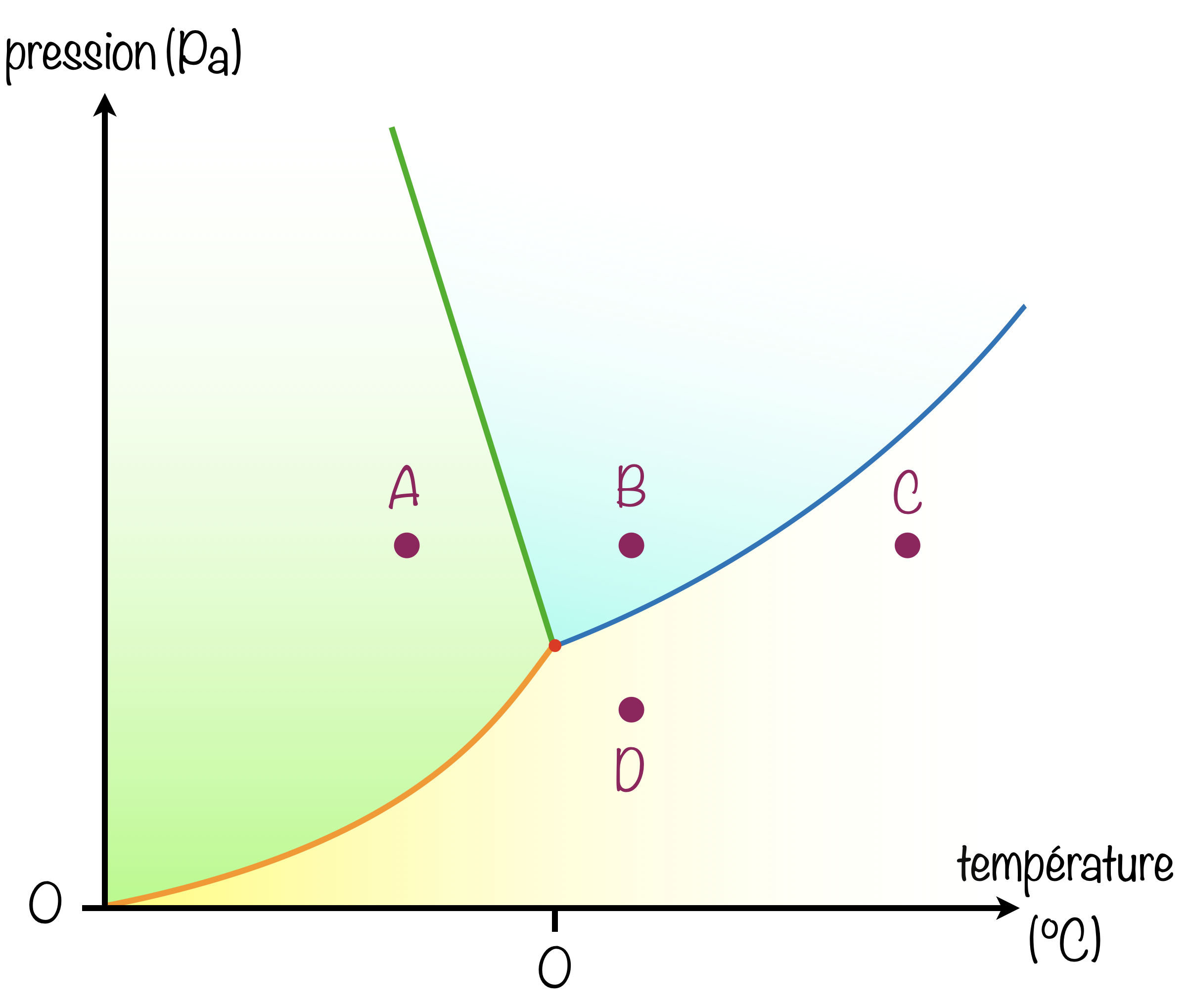
- [x] La transformation à température constante pour aller de D à B nécessite une liquéfaction.
- [ ] La transformation à pression constante pour aller de A à B nécessite deux changements de phase.
- [x] La transformation à pression constante pour aller de C à B nécessite une liquéfaction.
##
Pour un corps pur, lors de sa transformation physique :
- [x] l'énergie échangée est proportionnelle à sa masse.
- [ ] l'énergie échangée est proportionnelle à la température finale.
- [ ] l'énergie échangée est proportionnelle à la température initiale.
##
$L_v = \pu{199 kJ*kg-1}$ pour la vaporisation du diazote :
- [x] pour la liquéfaction du diazote $L = \pu{-199 kJ*kg-1}$
- [ ] cette valeur est également valable pour la vaporisation de l'eau
- [x] la vaporisation de $m=\pu{2,0 g}$ de diazote nécessite $\pu{4,0E2 J}$.