Réactions chimiques acido-basiques
Expérience
Questions :
- De quoi témoigne l'élévation de la température du ballon ?
- D'après le tableau suivant, que pouvez-vous dire de l'évolution du pH de la solution aqueuse une fois que l'ammoniac se dissout et réagit avec l'eau ?
- Par conséquent, l'ammoniac est-il une base ou un acide ?
- Comment expliquer le jaillisement de l'eau dans la 1re expérience et la contraction du ballon dans la 2e ?
- Quelle est l'équation de la réaction de l'ammoniac avec l'eau ?
Simulation
Testez la simulation et répondez aux questions suivantes :
Questions :
- Comment évolue le pH lorsqu'on dilue la solution ? Vers quelle valeur tend-il ?
- Comment évolue le rapport $\displaystyle\frac{\ce{[H3O+]}}{\ce{[HO-]}}$ lorsqu'on dilue la solution ? Vers quelle valeur tend-il ?
- Que vaut le ratio $\displaystyle \frac{\ce{[H3O+]}}{\ce{[HO-]}}$ lorsque le pH vaut 4 ? Et lorsque le pH vaut 10 ?
- Que vaut le produit $\ce{[H3O+]}\times \ce{[HO-]}$ lorsque le pH vaut 3 ? Lorsqu'il vaut 7 ? Et lorsqu'il vaut 12 ?
Que pouvez-vous déduire sur la grandeur $K_e = \ce{[H3O+]}\times \ce{[HO-]}$ appelée produit d'autoprotolyse de l'eau ?
- Déterminer $\ce{[H3O+]}$ lorsque le pH vaut 3,5 grâce à la simulation et vérifier par le calcul. En déduire $\ce{[HO-]}$ grâce à la question précédente.
- Déterminer le pH lorsque $\ce{[H3O+]}=\pu{2E-9 mol*L-1}$ grâce à la simulation. Vérifier par le calcul.
Savoir et savoir faire
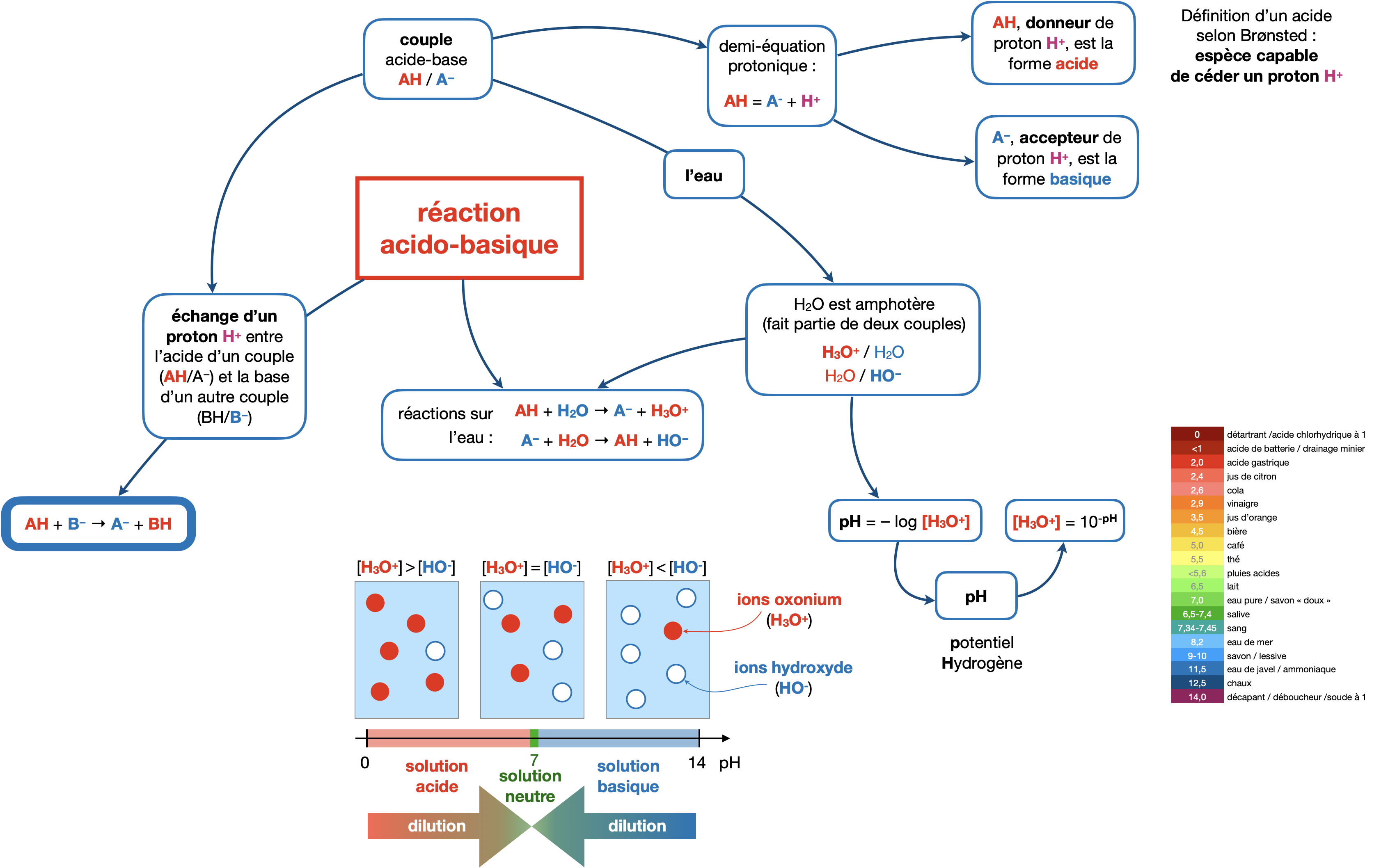
Identifier un acide par sa capacité à céder un ion $\ce{H+}$, en déduire la base conjuguée.
Écrire l’équation de la réaction entre un acide et une base à partir des couples acide-base.
Calculer un pH à partir de $\ce{[H3O+]}$ et inversement, calculer $\ce{[H3O+]}$ à partir d’un pH.
Savoir comment évolue le pH lors d’une dilution.
La précision d’une mesure au pH-mètre est d’un chiffre après la virgule (0,1 unité de pH). Conséquence : on ne note jamais un pH avec plus d’un chiffre après la virgule.
⚠️ La concentration en ions oxonium $\ce{[H3O+]}$ déduite d’une mesure de pH est toujours donnée avec 2 chiffres significatifs, même lorsque la mesure de pH en comporte 3.
Attention à bien écrire pH, petit p, grand H, pour “potentiel Hydrogène”.
Une solution aqueuse peut-être acide (pH < 7) alors qu’une base est le soluté majoritaire dans la solution et inversement.
Par exemple, l’espèce majoritaire dans une solution contenant le couple $\ce{(CH3COOH/CH3COO^-)}$ est la base $\ce{CH3COO-}$ si le pH vaut 5,5 !
Mais ajouter un acide dans la solution fera toujours ➘ le pH alors qu’ajouter une base le fera ➚.
$\ce{H3O^+}$ et $\ce{H^+(aq)}$ désignent la même chose !
Pour une réaction acidobasique dans l’eau on utilise $\ce{H3O+}$, mais pour une réation d’oxydoréduction dans l’eau, on utilise plus souvent $\ce{H^+(aq)}$. Dans ce cas, on a $\text{pH}=-\log(\ce{H^+(aq)})$.
Documents
-
TP :
TP chou rouge -
Exos :
Retenue d’eau (extrait sujet 0)
Lessive (extrait sujet 2022 métropole)
Analyse d’un échantillon de glace (bac blanc - sujet 2023 Mayotte-Liban)
Quiz
- [x] $\ce{SO2,H2O + NO3^- \longrightarrow HSO3^- + HNO3}$ - [ ] $\ce{SO2,H2O + HNO3 \longrightarrow HSO3^- + NO3^-}$ - [ ] $\ce{HSO3^- + HNO3 \longrightarrow SO2,H2O + NO3^-}$ ## L'acide du couple $\ce{(HCO3^-/CO3^2-)}$ réagit avec l'eau qui appartient aux deux couples suivant : $\ce{(H2O/HO^-)}$ et $\ce{(H3O+/H2O)}$. L'équation de réaction s'écrit :
- [x] $\ce{HCO3^- + H2O \longrightarrow CO3^2- + H3O+}$ - [ ] $\ce{HCO3^- + H2O \longrightarrow CO3^2- + HO-}$ - [ ] $\ce{HCO3^- + HO- \longrightarrow CO3^2- + H2O}$ ## Pour mesurer le pH d'une solution aqueuse, on peut utiliser : - [x] un papier pH - [x] un indicateur coloré de pH - [x] un pH-mètre ## La relation liant le pH à la concentration molaire en ions oxonium $\ce{H3O+}$ est : - [x] $\text{pH} = -\log\ce{[H3O+]}$ - [ ] $\text{pH} = 10^{-\ce{[H3O+]}}$ - [ ] $\ce{[H3O+]} = -\log \text{pH}$ ## Le pH d'une solution de concentration molaire $\ce{[H3O+]}=\pu{10^-5 mol*L-1}$ vaut : - [x] $5$ - [ ] $-5$ - [ ] $\log 5$ ## La concentration molaire $\ce{[H3O+]}$ d'une solution de $\text{pH}= 8,4$ vaut : - [x] $\pu{10^{-8,4} mol*L-1}$ - [x] $\pu{4,0*10^{-9} mol*L-1}$ - [ ] $\pu{10^{8,4} mol*L-1}$ ## Un pH-mètre affiche 10,23, nous pouvons conserver comme résultat : - [x] $10,2$ - [ ] $10,23$ - [ ] $10$ ## La concentration molaire des ions oxonium qui correspond à cet affichage de 10,23 est : - [x] inférieure à celle que l'on trouve dans l'eau pure - [ ] supérieure à celle que l'on trouve dans l'eau pure - [ ] sensiblement égale à celle que l'on trouve dans l'eau pure ## La concentration molaire des ions oxonium qui correspond à cet affichage de 10,23 doit se noter : - [x] $\pu{5,9E-11 mol*L-1}$ - [ ] $\pu{5,89E-11 mol*L-1}$ - [ ] $\pu{6E-11 mol*L-1}$ ## Lorsqu'on ajoute de l'eau distillée à une solution basique : - [x] le pH diminue - [ ] le pH augmente - [ ] le pH reste constant ## Lorsqu'on ajoute de l'eau distillée à une solution acide : - [ ] le pH diminue - [x] le pH augmente - [x] le pH se rapproche de 7 ## Pour diluer une solution de pH très faible ou très élevé, il faut : - [x] verser la solution concentrée goutte à goutte dans l'eau - [ ] verser l'eau goutte à goutte dans la solution concentrée - [ ] verser la solution dans l'eau ou l'inverse, ça n'a pas d'importance > Lors du mélange, il se produit une réaction chimique très exothermique (forte libération de chaleur).
> Les premières gouttes mélangées (acide dans eau ou eau dans acide) risque de faire localement monter la température au-delà de la température de vaporisation entraînant des projections.
> Dans le cas d'ajout goutte à goutte de l'eau dans l'acide, on risque de principalement projeter de l'acide.
> À l'inverse, dans le cas de l'ajout d'acide dans l'eau, c'est surtout de l'eau qui rique d'être projetée.
