Évolution spontanée d’un système chimique
Documents
| TP | Equilibre chimique + + |
|---|---|
| Activité | Pluie dorée |
| Exercice | Ion salicylate (dissolution, dilution, avancement, équilibre, dosage par étalonnage spectrophotométrique) |
Définitions
Avancement maximal
Avancement associé à la disparition totale du réactif limitant.
Taux d'avancement
Rapport de la valeur finale de l’avancement sur celle de l’avancement maximal :
$$\tau=\frac{x_\mathrm{final}}{x_\mathrm{max}}$$
Transformation totale ou non totale
Une transformation est dite totale si le taux d’avancement final est égal à 1 ($\tau=1$).
À l’état final d’une transformation totale, au moins une des espèces chimiques présentes à l’état initial a disparu.
S’il est inférieur à 1 ($\tau<1\Leftrightarrow x_\mathrm{final}<x_\mathrm{max}$), la transformation est dite non-totale.
note
Un soluté ou un gaz ne disparaissent jamais totalement d’un milieu. Ainsi, toute transformation consommant exclusivement des solutés et/ou gaz ne peut être totale. Dans certains cas, le taux d’avancement final est si proche de 1 que la transformation peut être qualifiée de quasi-totale. Une transformation chimique n’est rigoureusement totale que si une phase condensée pure (liquide pur ou solide pur) a disparu.
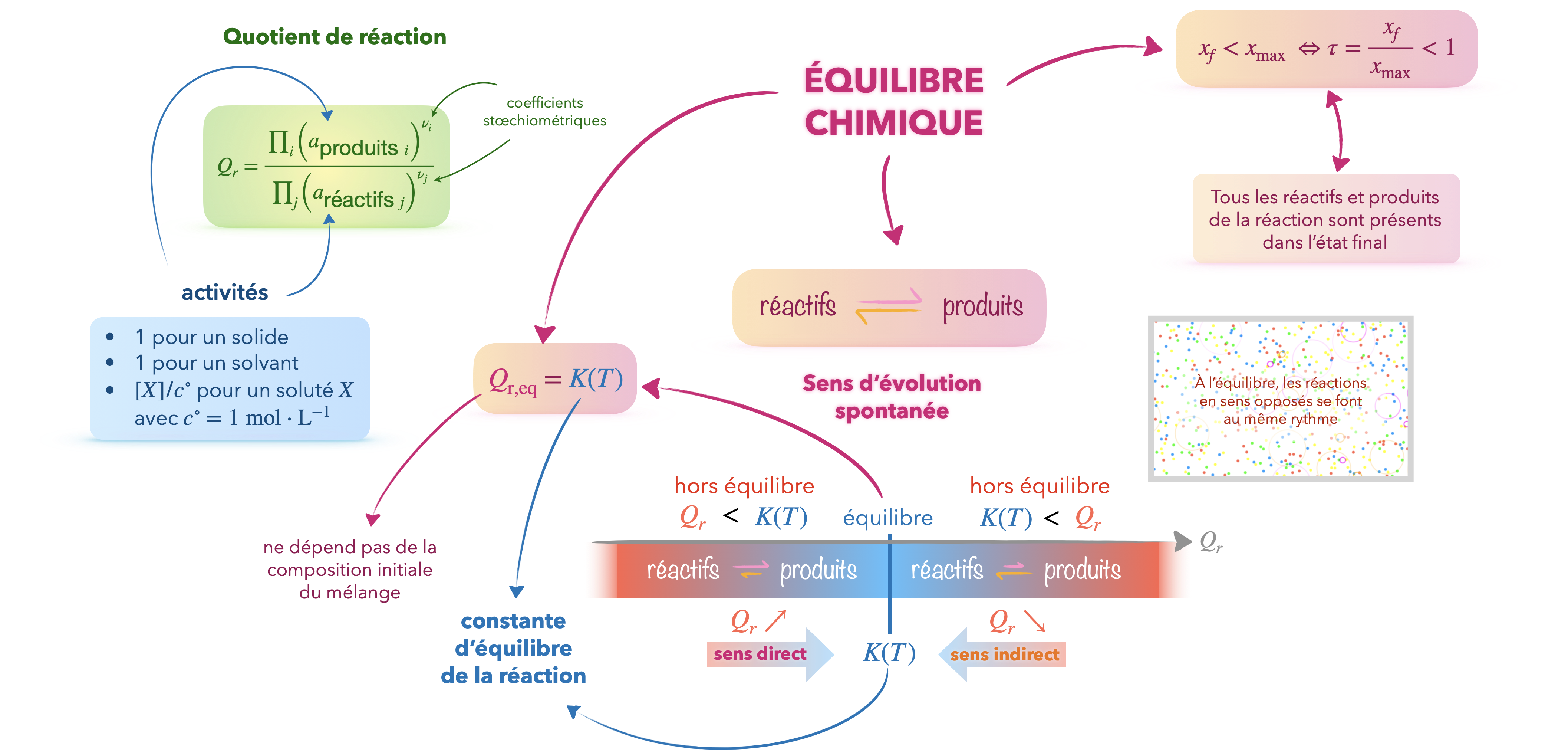
Quotient de réaction
Grandeur adimensionnée définie par la relation ci-dessous dans laquelle interviennent les activités des espèces chimiques réactives et produites apparaissant dans l’équation de la réaction et les nombres stœchiométriques qui leur sont associés, considérés ici positifs : $$\displaystyle Q_r=\frac{\prod_i\left(a_{\text {produits } i}\right)^{\nu_i}}{\prod_j\left(a_{\text {réactifs } j}\right)^{\nu_j}}$$
info
L’activité d’un solvant est prise égale à 1,
celle d’une espèce soluté est le rapport $C_i/C°$ de sa concentration $C_i$ en quantité de matière sur la concentration standard,
celle d’un solide est prise égale à 1.
Un système est à l’équilibre chimique s’il vérifie, à l’état final, les conditions suivantes :
l’ensemble des réactifs et produits de la réaction coexistent et leurs quantités de matière n’évoluent plus dans le temps ;
le quotient de réaction \( Q_r \) prend une valeur notée \( K(T) \), indépendante de la composition initiale, appelée constante d’équilibre.
info
Pour une réaction donnée, la valeur de $K(T)$ ne dépend que de la température. Elle est par conséquent indépendante de la pression et des quantités de matière mises en œuvre.
note
L’équilibre chimique est modélisé par deux réactions opposées dont les effets se compensent une fois l’équilibre chimique atteint.
Sens d’évolution spontanée d’un système chimique
En l’absence de générateur, le sens d’évolution spontanée est celui qui modifie la valeur du quotient de réaction pour le rapprocher de la constante d’équilibre ($Qr\rightarrow K(T)$).
L’état d’équilibre final du système résulte de l’une des deux situations suivantes :
l’état final est un état d’équilibre chimique caractérisé par la relation $Q_{r,\mathrm{eq}}=K(T)$, la transformation n’est pas totale ;
la disparition d’un réactif (solide ou liquide pur) intervient avant que la valeur du quotient de réaction n’atteigne $K(T)$, la transformation est totale.
info
En présence d’un générateur (système siège d’une électrolyse), le sens d’évolution du système peut être contrôlé par l’expérimentateur :
le générateur impose le sens de circulation des électrons dans le circuit extérieur, et par conséquent, le sens des transferts électroniques aux électrodes.