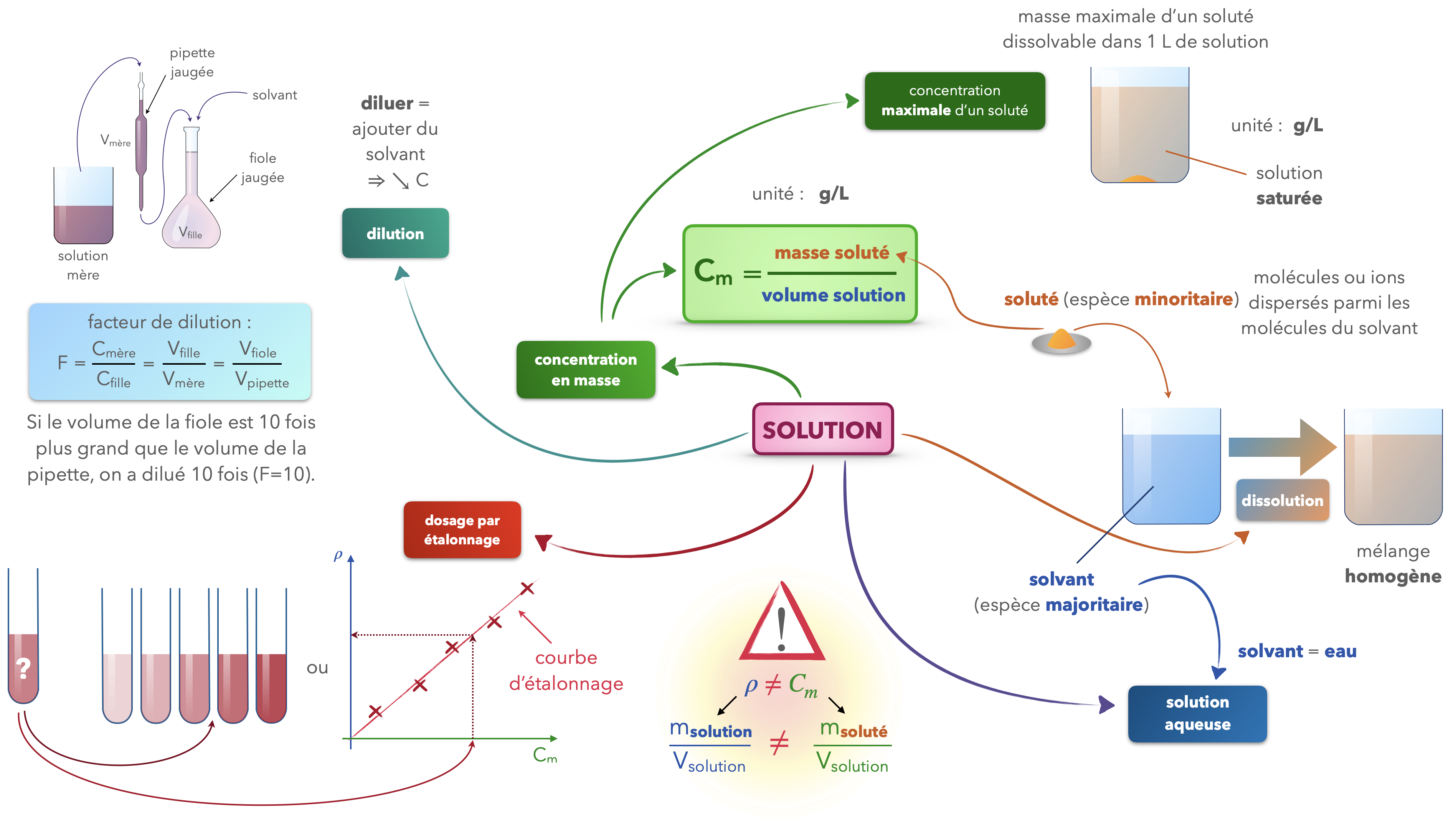
Solutions
Définitions
Mélange homogène dans lequel l’eau est le constituant ultra-majoritaire. Elle y joue le rôle de solvant, les espèces chimiques dissoutes sont qualifiées de solutés.
Exemple :
Le vinaigre est, en première approximation, une solution aqueuse d’acide éthanoïque (soluté).
Masse d’une espèce chimique dissoute par litre de solution. La concentration en masse peut s’exprimer en g/L.
Exemple :
Une solution de chlorure de sodium de concentration en masse 10 g/L est obtenue en introduisant 10 g de chlorure de sodium dans une fiole jaugée de 1,0 L et en ajoutant de l’eau jusqu’à obtenir un volume final de mélange égal à 1,0 L.
Masse maximale d’une espèce chimique qui peut être dissoute par litre de solution.
Exemple :
La concentration maximale du chlorure de sodium dans l’eau à 25 °C est égale à $\pu{3,6E2 g}$ de sel par litre de solution.
Méthode de détermination d’une concentration, généralement non destructive, utilisant une courbe de référence liant la valeur d’une grandeur physique (absorbance, conductivité, masse volumique, etc.) à la concentration d’un soluté. La courbe de référence, appelée courbe d’étalonnage, doit être monotone sur l’intervalle de concentration encadrant la concentration inconnue. La courbe n’est pas nécessairement une droite, mais cette situation permet d’obtenir une précision constante quelle que soit la valeur de la concentration recherchée.
Exemples :
Dosage du chlorure de sodium dans du sérum physiologique par mesure de la conductance, dosage du sucre dans une boisson sucrée par mesure de masse volumique, dosage des ions permanganate par mesure d’absorbance.
Documents
| Protocoles | Dissolution |
|---|---|
| Dilution | |
| Tutos | Utilisation de la verrerie |
| TP | Précision de la verrerie |
| Masse de sucre dans une boisson | |
| Dissolution et dilution | |
| Échelle de teinte |
Quiz
Le mélange de liquides est le suivant (pour 10 L finaux) : 8,333 L d'éthanol à 96 %, 417 mL de solution de peroxyde d'hydrogène à 3 %, 174 g de glycérol à 98 % et le reste est complété avec de l'eau distillée.
Identifier le solvant dans la solution de gel hydroalcoolique : - [x] l'éthanol - [ ] le glycérol - [ ] l'eau ## Quel est le schéma de la fiole jaugée ? - [x]
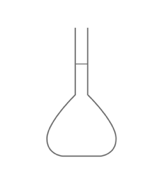 - [ ]
- [ ] 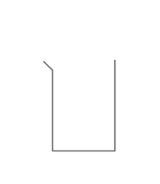 - [ ]
- [ ] 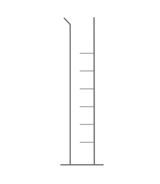 - [ ]
- [ ]  ##
La concentration en masse d'un soluté est le quotient de la masse de soluté par le volume de :
- [x] solution
- [ ] solvant
- [ ] soluté
##
Comment obtient-on le volume $V$ d'une solution à partir d'une concentration en masse $C_m$ et d'une masse de soluté $m$ ?
- [x] $V = \frac{m}{C_m}$
- [ ] $V = m\times C_m$
- [ ] $V = \frac{C_m}{m}$
##
Quelle est la différence entre la formule permettant d'obtenir la masse volumique d'une solution et la formule permettant d'obtenir la concentration en masse de la solution ?
- [x] le numérateur
- [ ] le dénominateur
- [ ] le numérateur et le dénominateur
##
Quelles pièces de verrerie faut-il utiliser pour réaliser une dilution ?
- [x] fiole jaugée et pipette jaugée
- [ ] fiole jaugée et pipette graduée
- [ ] éprouvette graduée et pipette graduée
##
Quelles sont les unités valides pour une concentration en masse ?
- [x] le $\pu{kg*L-1}$
- [x] le $\pu{g/L}$
- [x] le $\pu{g/mL}$
- [ ] le $\pu{L/kg}$
##
On dissout 1,0 g de sel dans 200 mL. La concentration en sel est de :
- [ ] $\pu{200 g*L-1}$
- [ ] $\pu{50 g*L-1}$
- [x] $\pu{5,0 g*L-1}$
- [ ] $\pu{2,0 g*L-1}$
- [x] $\pu{5,0E-3 g*mL-1}$
##
Pour préparer une solution à $\pu{4 g/L}$ en sucre avec $\pu{0,5 g}$ de sucre, il faut :
- [ ] une fiole jaugée de $\pu{200 mL}$
- [ ] une éprouvette de $\pu{200 mL}$
- [x] une fiole jaugée de $\pu{125 mL}$
- [ ] une éprouvette de $\pu{125 mL}$
##
On cherche à dissoudre $\pu{40 mg}$ de cristaux de diiode dans $\pu{100 mL}$ d'eau. Donner la masse de diiode qui se dépose au fond sans se dissoudre sachant que la concentration maximale en diiode (ou solubilité) est de $\pu{330 mg/L}$ dans ces conditions expérimentales.
- [x] $\pu{7 mg}$
- [ ] $\pu{0 mg}$ (la solution n'est pas saturée)
- [ ] $\pu{293 mg}$
- [ ] $\pu{67 mg}$
##
On ajoute maintenant $\pu{10 mg}$ de diiode à la solution précédente. Que vaut la concentration en masse de la solution ?
- [x] $\pu{330 mg/L}$
> la solution est saturée et a donc une concentration fixée à la concentration maximale !
- [ ] $\pu{340 mg/L}$
- [ ] $\pu{500 mg/L}$
##
Lors d'une dilution, la solution fille est :
- [ ] plus concentrée que la solution mère.
- [x] moins concentrée que la solution mère.
- [ ] autant concentrée que la solution mère.
##
Lors d'une dilution :
- [ ] le volume de solution ne change pas.
- [x] la masse de soluté ne change pas.
- [ ] la concentration ne change pas.
##
On cherche à obtenir $\pu{250 mL}$ d'une solution d'hydrogénocarbonate de sodium à une concentration de $\pu{0,24 g/L}$ à partir d'une solution de concentration $\pu{12 g/L}$. Vous choisissez une pipette jaugée de
- [ ] $\pu{50 mL}$
- [x] $\pu{5 mL}$
- [ ] $\pu{2 mL}$
- [ ] $\pu{20 mL}$
##
La concentration en masse d'un soluté est le quotient de la masse de soluté par le volume de :
- [x] solution
- [ ] solvant
- [ ] soluté
##
Comment obtient-on le volume $V$ d'une solution à partir d'une concentration en masse $C_m$ et d'une masse de soluté $m$ ?
- [x] $V = \frac{m}{C_m}$
- [ ] $V = m\times C_m$
- [ ] $V = \frac{C_m}{m}$
##
Quelle est la différence entre la formule permettant d'obtenir la masse volumique d'une solution et la formule permettant d'obtenir la concentration en masse de la solution ?
- [x] le numérateur
- [ ] le dénominateur
- [ ] le numérateur et le dénominateur
##
Quelles pièces de verrerie faut-il utiliser pour réaliser une dilution ?
- [x] fiole jaugée et pipette jaugée
- [ ] fiole jaugée et pipette graduée
- [ ] éprouvette graduée et pipette graduée
##
Quelles sont les unités valides pour une concentration en masse ?
- [x] le $\pu{kg*L-1}$
- [x] le $\pu{g/L}$
- [x] le $\pu{g/mL}$
- [ ] le $\pu{L/kg}$
##
On dissout 1,0 g de sel dans 200 mL. La concentration en sel est de :
- [ ] $\pu{200 g*L-1}$
- [ ] $\pu{50 g*L-1}$
- [x] $\pu{5,0 g*L-1}$
- [ ] $\pu{2,0 g*L-1}$
- [x] $\pu{5,0E-3 g*mL-1}$
##
Pour préparer une solution à $\pu{4 g/L}$ en sucre avec $\pu{0,5 g}$ de sucre, il faut :
- [ ] une fiole jaugée de $\pu{200 mL}$
- [ ] une éprouvette de $\pu{200 mL}$
- [x] une fiole jaugée de $\pu{125 mL}$
- [ ] une éprouvette de $\pu{125 mL}$
##
On cherche à dissoudre $\pu{40 mg}$ de cristaux de diiode dans $\pu{100 mL}$ d'eau. Donner la masse de diiode qui se dépose au fond sans se dissoudre sachant que la concentration maximale en diiode (ou solubilité) est de $\pu{330 mg/L}$ dans ces conditions expérimentales.
- [x] $\pu{7 mg}$
- [ ] $\pu{0 mg}$ (la solution n'est pas saturée)
- [ ] $\pu{293 mg}$
- [ ] $\pu{67 mg}$
##
On ajoute maintenant $\pu{10 mg}$ de diiode à la solution précédente. Que vaut la concentration en masse de la solution ?
- [x] $\pu{330 mg/L}$
> la solution est saturée et a donc une concentration fixée à la concentration maximale !
- [ ] $\pu{340 mg/L}$
- [ ] $\pu{500 mg/L}$
##
Lors d'une dilution, la solution fille est :
- [ ] plus concentrée que la solution mère.
- [x] moins concentrée que la solution mère.
- [ ] autant concentrée que la solution mère.
##
Lors d'une dilution :
- [ ] le volume de solution ne change pas.
- [x] la masse de soluté ne change pas.
- [ ] la concentration ne change pas.
##
On cherche à obtenir $\pu{250 mL}$ d'une solution d'hydrogénocarbonate de sodium à une concentration de $\pu{0,24 g/L}$ à partir d'une solution de concentration $\pu{12 g/L}$. Vous choisissez une pipette jaugée de
- [ ] $\pu{50 mL}$
- [x] $\pu{5 mL}$
- [ ] $\pu{2 mL}$
- [ ] $\pu{20 mL}$