Corps purs et mélanges
Définitions
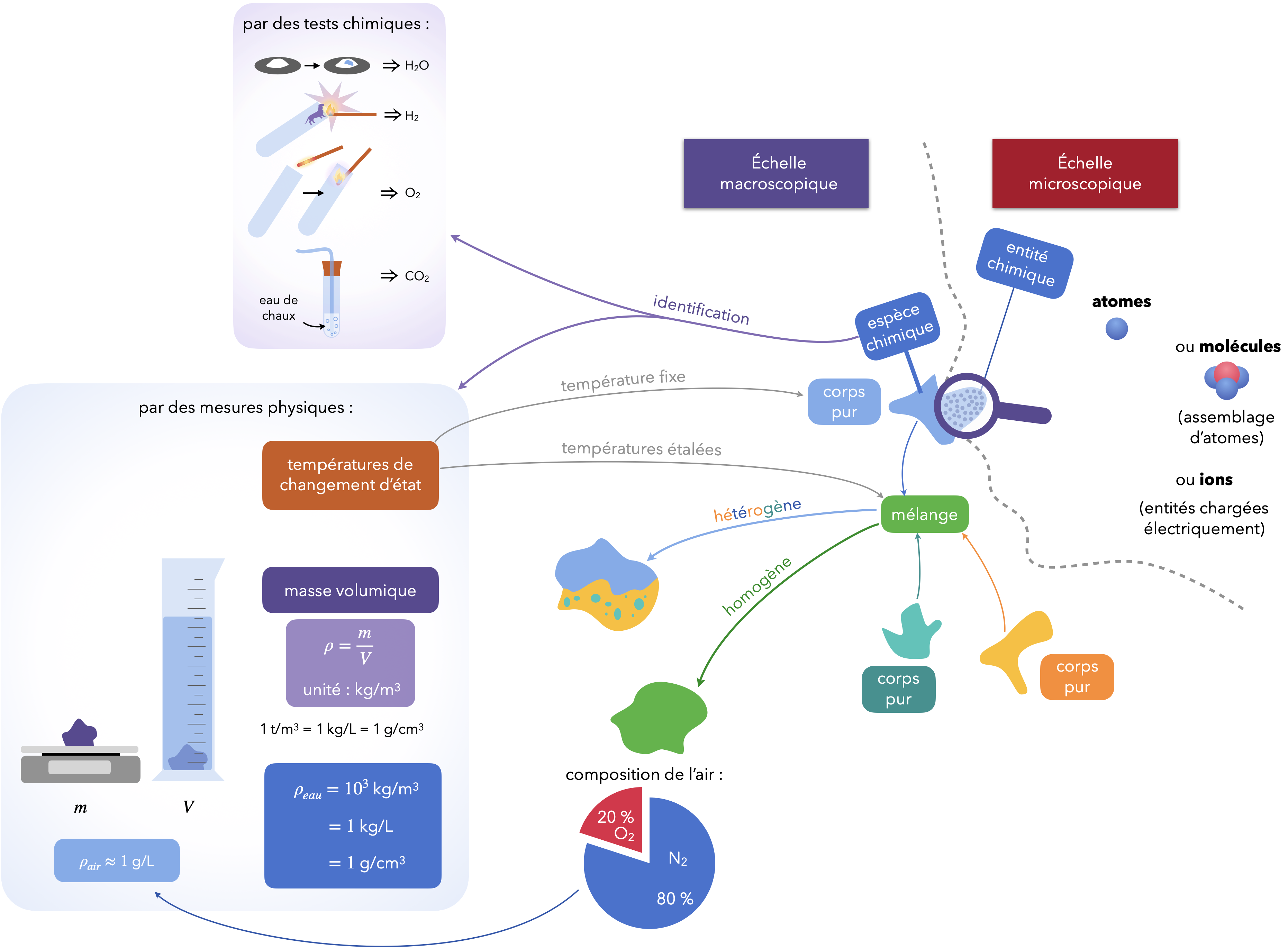
Échelles de description de la matière
Entité chimique
Objet pouvant être dénombré. Les atomes isolés, les ions, les molécules sont des entités chimiques. Une entité peut être décrite au moyen d’une formule chimique.
Échelle microscopique
Échelle de description rassemblant un nombre restreint d’entités, notamment adaptée à l’étude de la structure et aux propriétés des entités chimiques.
Échelle macroscopique
Échelle de description rassemblant un nombre suffisamment élevé d’entités pour que des grandeurs comme la pression, la température, la masse volumique, etc. puissent être définies. Les phénomènes décrits à l’échelle macroscopique peuvent être associés à des manifestations perceptibles par les sens ou étudiés à l’aide d’instruments de mesure (balance, thermomètre, capteur de pression, voltmètre, spectrophotomètre, pH-mètre, conductimètre, etc.).
Caractérisation d’un échantillon de matière
Espèce chimique
Collection d’entités chimiques identiques (à l’échelle macroscopique).
Le nom de l’espèce chimique (échelle macro) est souvent utilisé pour désigner l’entité (échelle micro). De même, la formule chimique de l’entité (échelle micro) peut servir à désigner l’espèce chimique (échelle macro).
L’eau présente dans un élément de verrerie est une collection de molécules de formule chimique $\ce{H2O}$. Le nom de l’espèce chimique « eau » est utilisé pour nommer l’entité moléculaire associée : « la molécule d’eau de formule $\ce{H2O}$ ». Inversement, la formule chimique de l’entité est utilisée pour désigner l’espèce chimique eau : « l’eau de formule chimique $\ce{H2O}$ »
note
L’espèce chimique est un modèle. Aucun échantillon de matière naturel n’est pur.
info
L’état physique de l’espèce chimique peut être adossé après sa formule ainsi, on écrira $\ce{H2O(s)}$ pour désigner la glace.
Mélange et corps pur
Un mélange est un échantillon de matière constitué de plusieurs espèces chimiques, par opposition à un corps pur constitué d’une seule espèce chimique.
Exemples :
L’eau du robinet est un mélange d’eau et de différentes espèces dissoutes. L’air est un mélange de plusieurs espèces chimiques dont le diazote et le dioxygène. L’or à 18 carats est un mélange de deux espèces métalliques, l’or et le cuivre.
Mélange homogène/hétérogène
Un mélange est dit homogène s’il ne présente qu’une seule phase. La masse volumique y évolue de manière continue (pas de frontière nette).
Un mélange est dit hétérogène s’il présente plusieurs phases. La masse volumique présente une discontinuité à l’interface entre deux phases (frontières). L’une des phases peut être dispersée dans l’autre.
Exemple :
Le vinaigre est un mélange homogène constitué essentiellement d’eau et d’acide éthanoïque. Le lait est un mélange qui semble homogène s’il est regardé à l’oeil nu mais qui est en réalité hétérogène car constitué de gouttelettes de corps gras dispersées dans une solution aqueuse comme le montre une inspection à la loupe binoculaire ou au microscope.
Documents
| TP | Identification d'additifs alimentaires |
|---|---|
| Identifier avec la masse volumique | |
| Exercice | Couronne d'Archimède |
| Exercice interactif | Identifier via la masse volumique |
| Schémas de montage | Chromatographie sur couche mince |
| Animation | CCM |