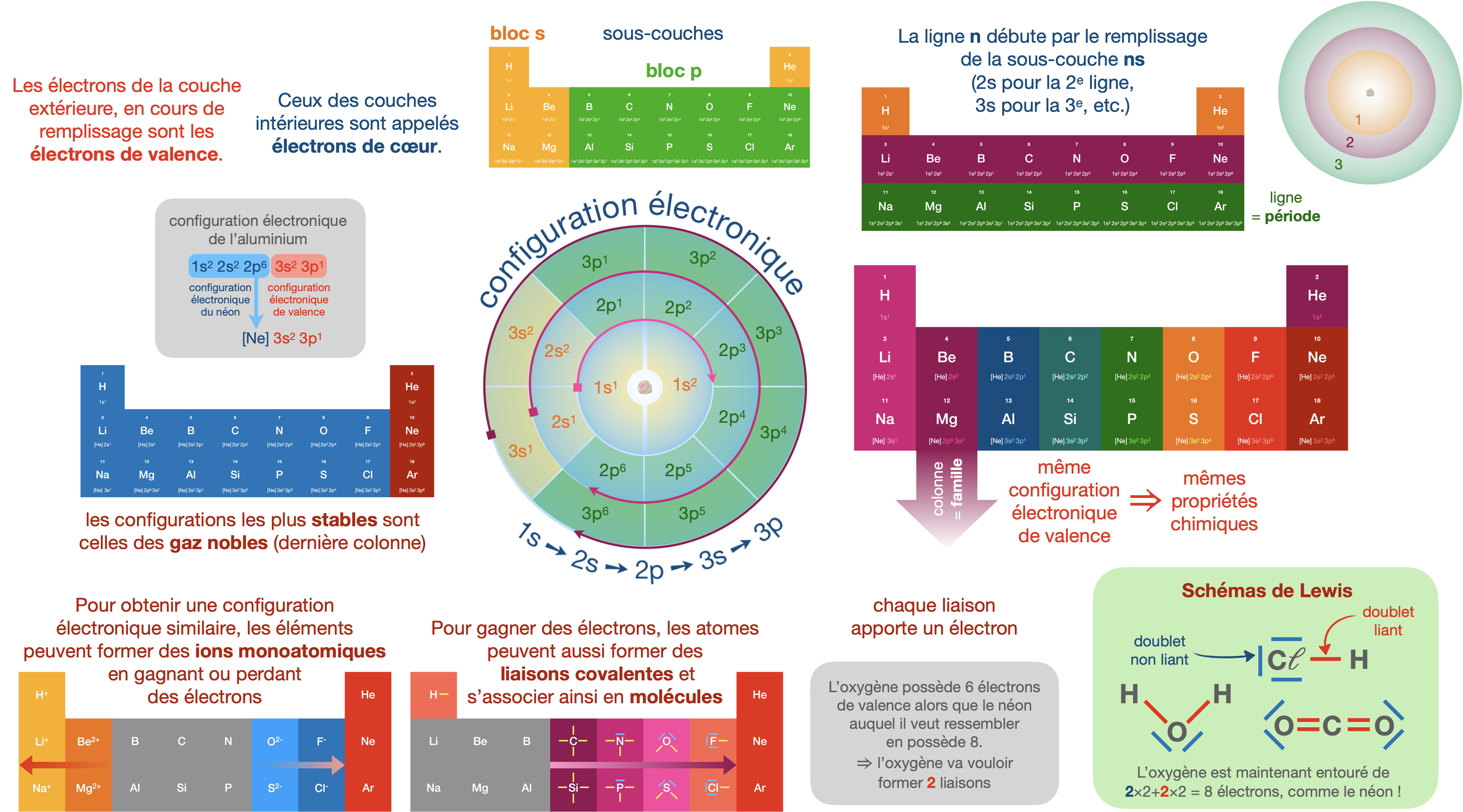
Cortège électronique et stabilité
Définitions
Répartition des électrons d’un atome dans les différentes couches et sous-couches.
Exemple :
La configuration électronique de l’atome de sodium (numéro atomique Z = 11) est
$\text{1s}^2\,\text{2s}^2\,\text{2p}^6\,\text{3s}^1$ à l’état fondamental. Cette configuration permet de retrouver la position de l’élément sodium dans le tableau périodique : il se situe dans la 3e période et la 1re colonne du bloc s, et par conséquent, la 1re colonne du tableau.
Ensemble des électrons appartenant à la couche de nombre quantique principal $n$ le plus élevé, ainsi que les électrons appartenant à des sous-couches partiellement remplies.
Exemple :
L’atome de sodium a un électron de valence à l’état fondamental, l’électron appartenant à la sous-couche $3\text{s}$.
Éléments chimiques appartenant à une même colonne du tableau périodique et partageant des propriétés chimiques et physiques similaires. La similarité des propriétés observées à l’échelle macroscopique est associée à l’échelle microscopique, à l’identité des configurations électroniques de valence pour les atomes isolés de ces éléments.
Exemple :
Le sodium, le potassium, le lithium, etc. ont en commun une configuration électronique fondamentale de l’atome isolé du type $\text{ns}^1$. Ils constituent la famille des alcalins.
Quiz
Combien de doublets doivent figurer dans le schéma de Lewis de la molécule $\ce{C2H3FO}$ ? - [ ] 9 - [x] 12 - [ ] 18 - [ ] 10 - [ ] 11 - [ ] 24 ## Molécule 2 --- shuffle_answers: false --- Parmi les schéma de Lewis, le(s)quel(s) corresponde(nt) à un gain de stabilité pour chaque élément ?  - [ ] A - [x] B - [ ] C - [ ] D
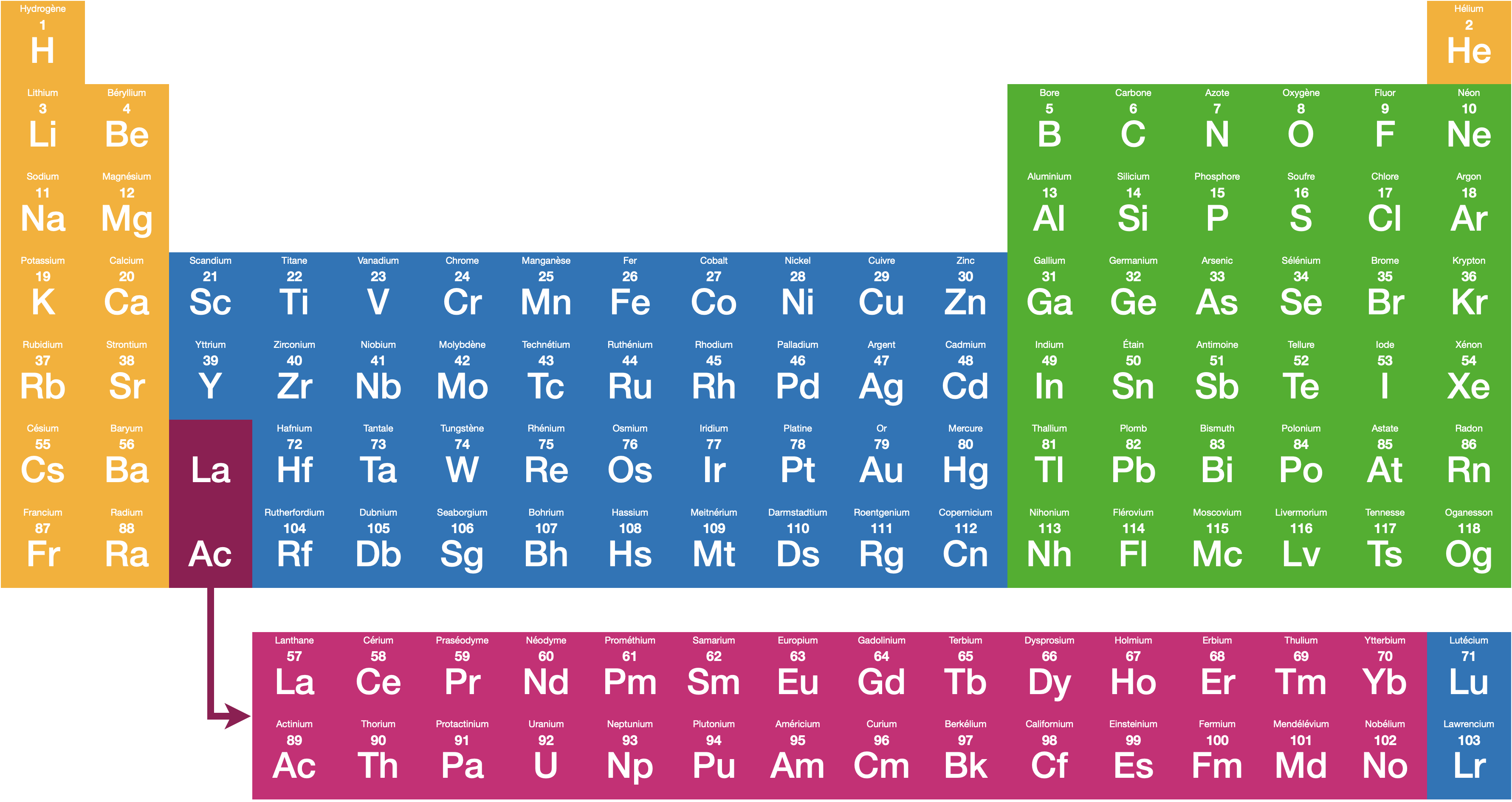
Tableau périodique des éléments
Le tableau ci-dessous est réduit aux 18 premiers éléments ($Z<18$).
Sont inscrits dans chaque case le symbole de l’élément, son numéro atomique, la configuration électronique stable de l’atome, et sa version condensée.
| Colonne 1 | Colonne 2 | ... | Colonne 13 | Colonne 14 | Colonne 15 | Colonne 16 | Colonne 17 | Colonne 18 |
| 1 H $\text{1s}^1$ |
2 He $\text{1s}^2$ |
|||||||
| 3 Li $\text{1s}^2\,\text{2s}^1$ $\ce{[He]}\,\text{2s}^1$ |
4 Be $\text{1s}^2\,\text{2s}^2$ $\ce{[He]}\,\text{2s}^2$ |
5 B $\text{1s}^2\,\text{2s}^2\,\text{2p}^1$ $\ce{[He]}\,\text{2s}^2\,\text{2p}^1$ |
6 C $\text{1s}^2\,\text{2s}^2\,\text{2p}^2$ $\ce{[He]}\,\text{2s}^2\,\text{2p}^2$ |
7 N $\text{1s}^2\,\text{2s}^2\,\text{2p}^3$ $\ce{[He]}\,\text{2s}^2\,\text{2p}^3$ |
8 O $\text{1s}^2\,\text{2s}^2\,\text{2p}^4$ $\ce{[He]}\,\text{2s}^2\,\text{2p}^4$ |
9 F $\text{1s}^2\,\text{2s}^2\,\text{2p}^5$ $\ce{[He]}\,\text{2s}^2\,\text{2p}^5$ |
10 Ne $\text{1s}^2\,\text{2s}^2\,\text{2p}^6$ $\ce{[He]}\,\text{2s}^2\,\text{2p}^6$ |
|
| 11 Na $\text{1s}^2\,\text{2s}^2\,\text{2p}^6\,\text{3s}^1$ $\ce{[Ne]}\,\text{3s}^1$ |
12 Mg $\text{1s}^2\,\text{2s}^2\,\text{2p}^6\,\text{3s}^2$ $\ce{[Ne]}\,\text{3s}^2$ |
13 Al $\text{1s}^2\,\text{2s}^2\,\text{2p}^6\,\text{3s}^2\,\text{3p}^1$ $\ce{[Ne]}\,\text{3s}^2\,\text{3p}^1$ |
14 Si $\text{1s}^2\,\text{2s}^2\,\text{2p}^6\,\text{3s}^2\,\text{3p}^2$ $\ce{[Ne]}\,\text{3s}^2\,\text{3p}^2$ |
15 P $\text{1s}^2\,\text{2s}^2\,\text{2p}^6\,\text{3s}^2\,\text{3p}^3$ $\ce{[Ne]}\,\text{3s}^2\,\text{3p}^3$ |
16 S $\text{1s}^2\,\text{2s}^2\,\text{2p}^6\,\text{3s}^2\,\text{3p}^4$ $\ce{[Ne]}\,\text{3s}^2\,\text{3p}^4$ |
17 Cl $\text{1s}^2\,\text{2s}^2\,\text{2p}^6\,\text{3s}^2\,\text{3p}^5$ $\ce{[Ne]}\,\text{3s}^2\,\text{3p}^5$ |
18 Ar $\text{1s}^2\,\text{2s}^2\,\text{2p}^6\,\text{3s}^2\,\text{3p}^6$ $\ce{[Ne]}\,\text{3s}^2\,\text{3p}^6$ |
Tableau complet faisant apparaître les 4 blocs correspondant aux 4 sous-couches $s$, $p$, $d$, et $f$ :