Oxydo-réduction
Demi-équation électronique
Une demi-équation électronique met en évidence, de manière formelle, l’existence d’un transfert d’électron(s) au cours d’une transformation convertissant l’oxydant d’un couple en son réducteur conjugué (ou l’inverse). La demi-équation ne modélise pas le déroulement microscopique de cet échange, mais illustre, à l’échelle macroscopique, les proportions dans lesquelles il s’opère.
Exemple :
La demi-équation électronique associée au couple $\left(\ce{Cr2O7^2-/Cr^3+}\right)$, montre que 3 moles d’électrons sont échangées par mole de chrome converti :
$$\ce{Cr2O7^2- + 14 H+ +6 e- = 2 Cr^3+ + 7H2O}$$
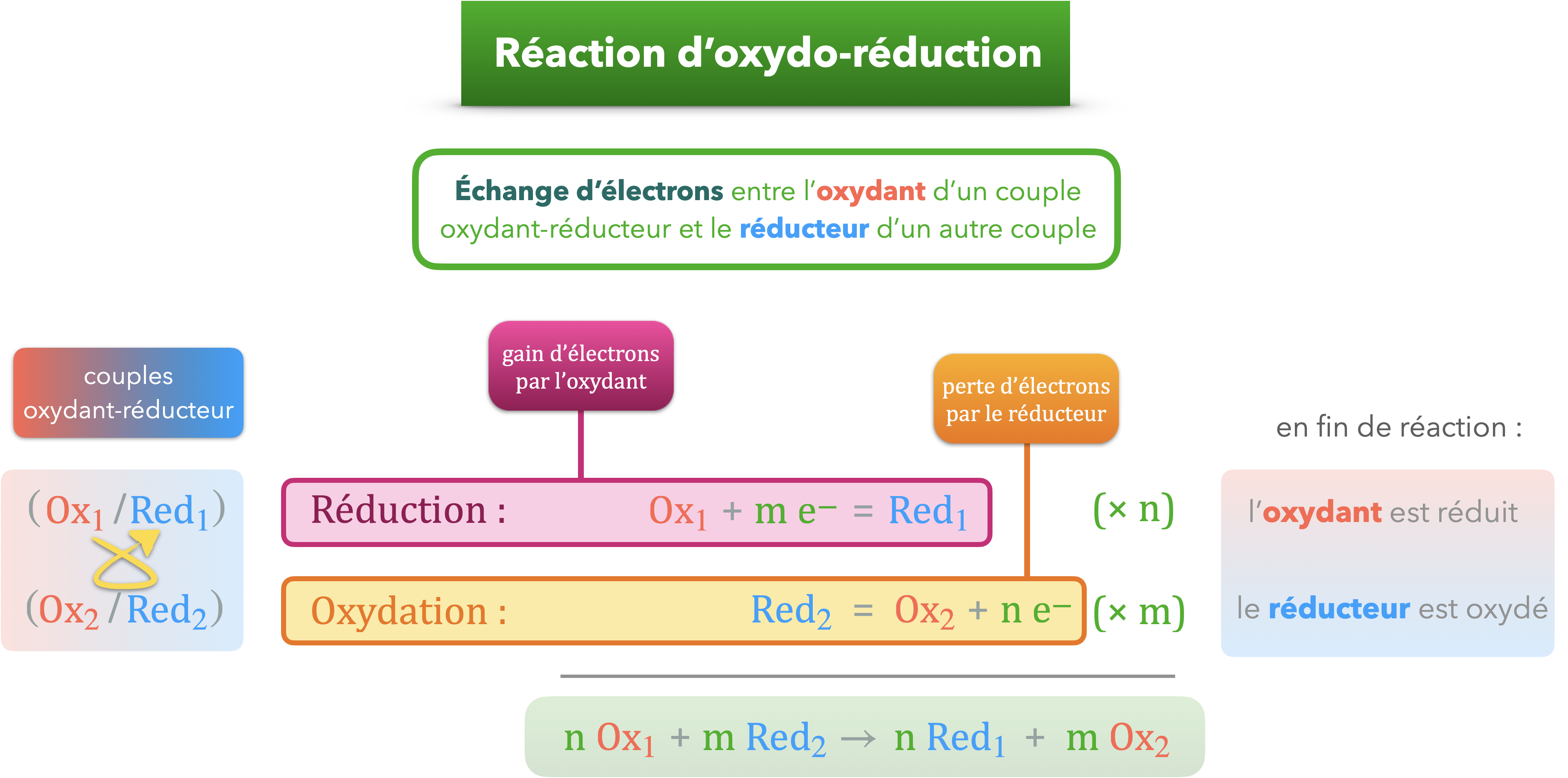
Réaction électrochimique ou d'oxydo-réduction
Modélisation, à l’échelle macroscopique, d’une transformation mettant en jeu un transfert d’électrons.
Exemple :
L’introduction d’un fil de cuivre dans une solution de nitrate d’argent, entraîne l’apparition d’une teinte bleue, associée à la formation d’ions $\ce{Cu^2+}$, et l’apparition d’un dépôt, à la surface du fil, identifié comme de l’argent. Le bilan des espèces formées et créées permet de mettre en évidence l’existence d’un transfert d’électrons par l’écriture de demi-équations électroniques. L’équation de la réaction modélisant la transformation peut être obtenue par combinaison des demi-équations électroniques puisqu’il n’y a pas d’électrons en solution aqueuse : $$\ce{Cu (s) = Cu^2+ (aq) + 2 e-}$$ $$\ce{Ag+ (aq) + e- = Ag (s)}$$
$$\ce{Cu (s) + 2 Ag+ (aq) -> Cu^2+ (aq) + 2 Ag (s)}$$
Quiz
Il s'agit d'une : - [ ] oxydation - [x] réduction ## Couple Soit la demi-équation électronique : $\ce{H2 (g) + 2 OH- (aq) = 2 H2O (l) + 2e-}$
Le couple oxydant-réducteur mis en jeu est : - [ ] $\left(\ce{H2/H2O}\right)$ - [x] $\left(\ce{H2O/H2}\right)$