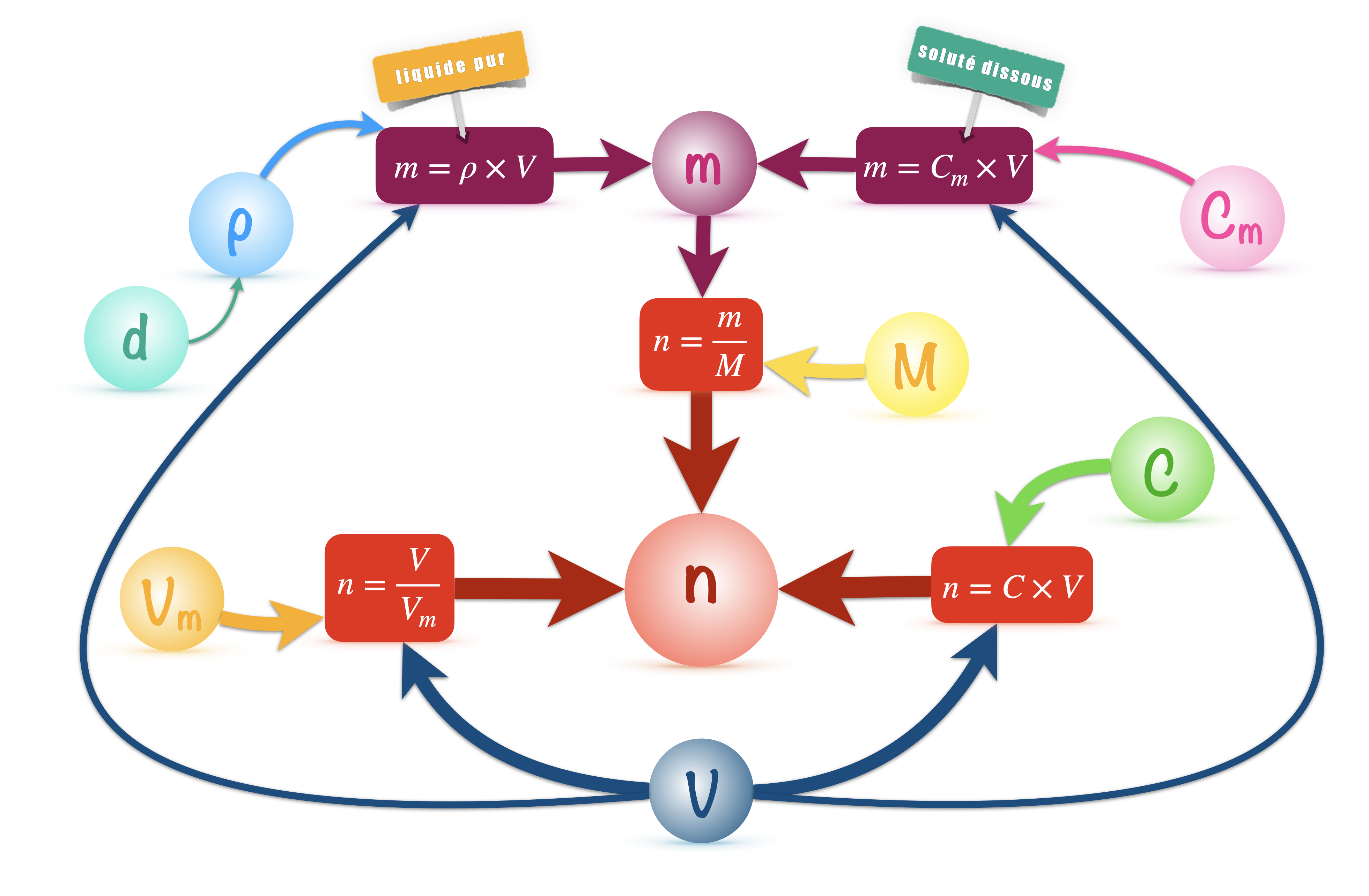
Composition du système initial
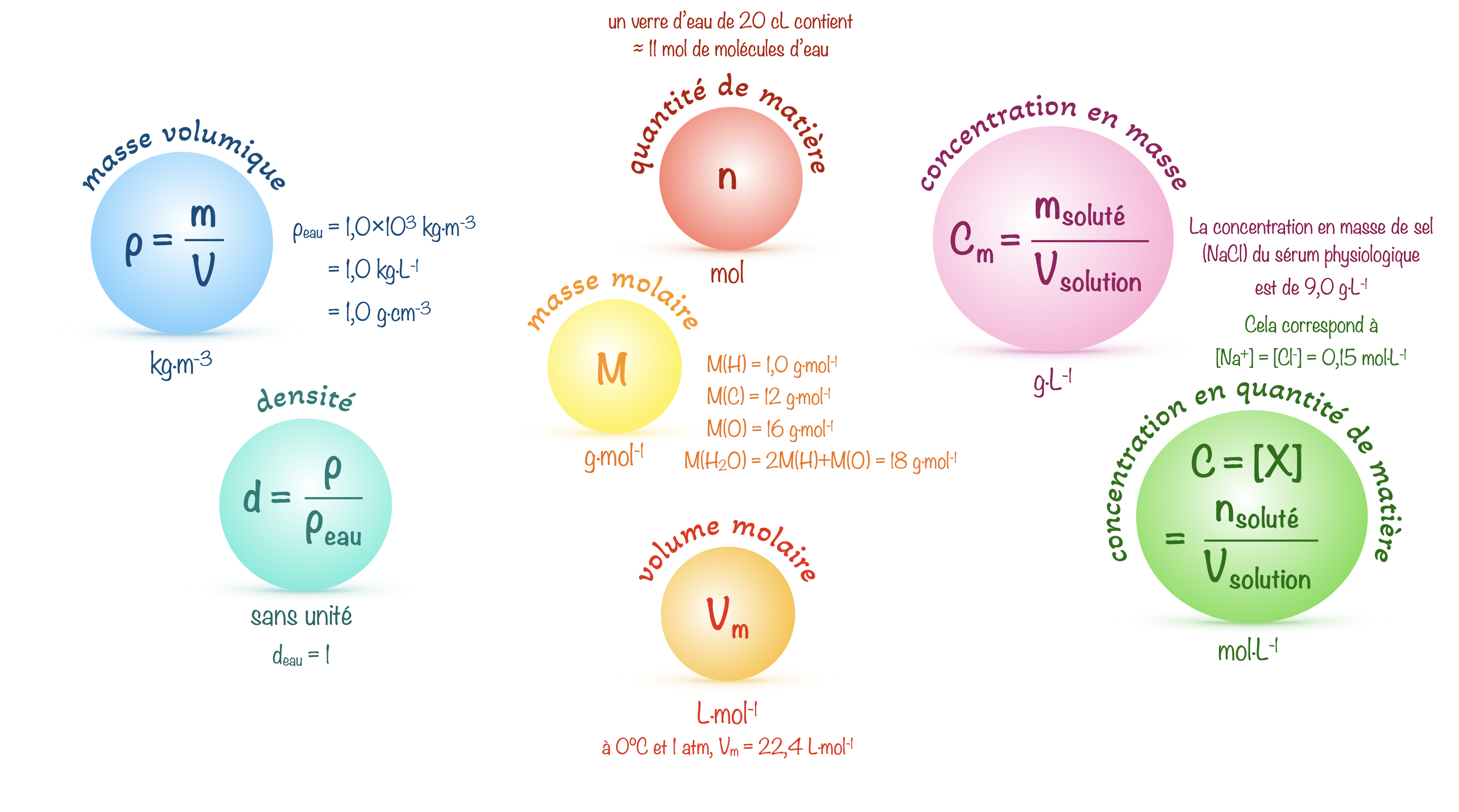
Les grandeurs à connaître en chimie
Concentration en quantité de matière
Quantité de matière d’une espèce chimique dissoute par litre de solution.
La concentration en quantité de matière peut s’exprimer en $\pu{mol*L-1}$.
Exemple :
Une solution de glucose de concentration en quantité de matière $\pu{0,10 mol*L-1}$ est obtenue en introduisant $\pu{0,10 mol}$ de glucose dans une fiole jaugée de $\pu{1,0 L}$ et en ajoutant de l’eau jusqu’à obtenir un volume final de mélange égal à $\pu{1,0 L}$.
Quiz
---
primary_color: steelblue
secondary_color: "#f2f2f2"
text_color: black
shuffle_questions: false
---
## Archimède
---
shuffle_answers: false
---
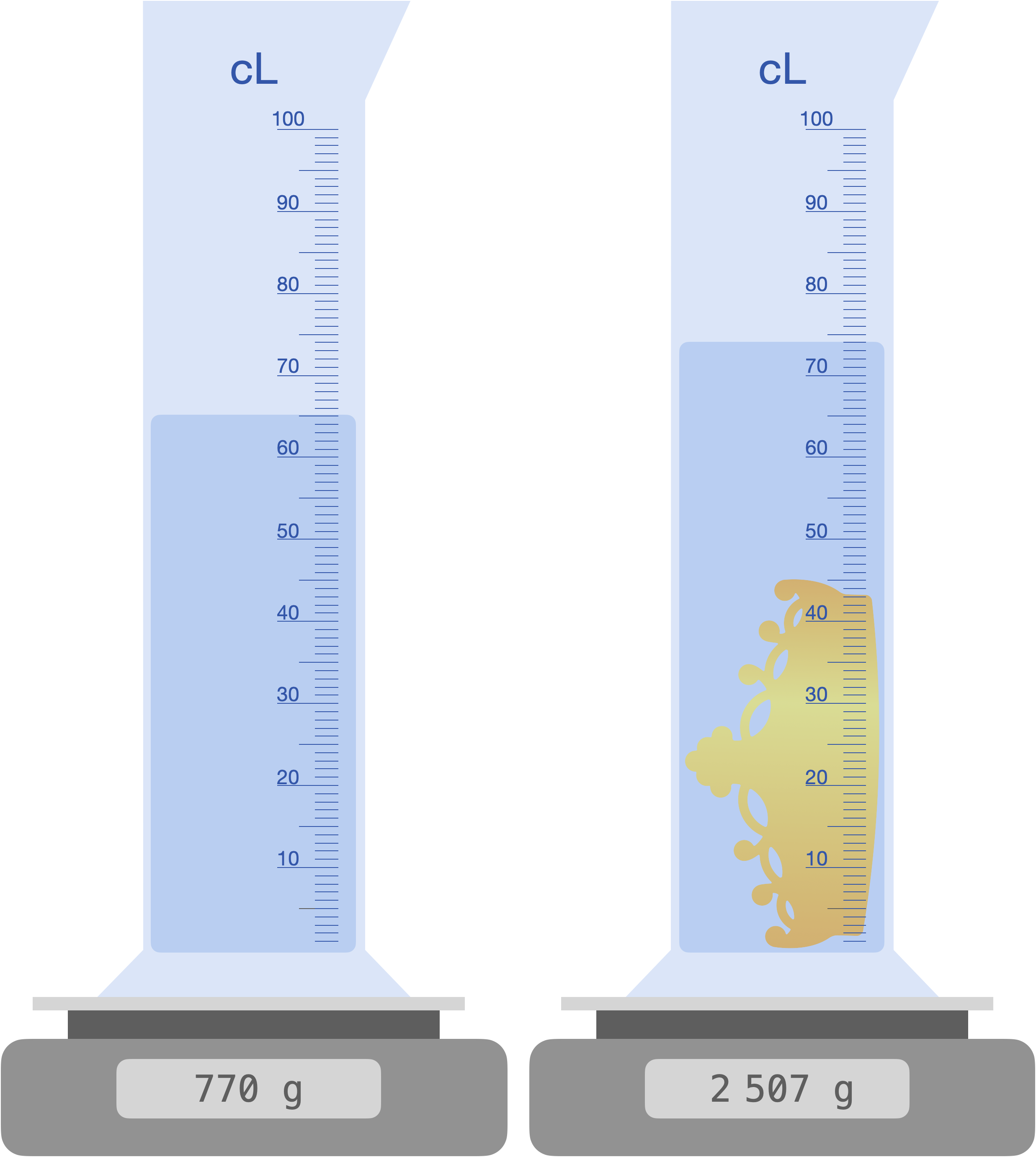 La couronne est-elle :
>
La couronne est-elle :
>
 - [ ] $\pu{45 g*mol-1}$
- [x] $\pu{46 g*mol-1}$
- [ ] $\pu{45 mol*g-1}$
- [ ] $\pu{46 mol*g-1}$
## Masse molaire d'un solide hydraté
Quelle est la masse molaire du sulfate de cuivre pentahydraté $\ce{CuSO4,5 H2O}$ ?
- [ ] $\pu{45 g*mol-1}$
- [x] $\pu{46 g*mol-1}$
- [ ] $\pu{45 mol*g-1}$
- [ ] $\pu{46 mol*g-1}$
## Masse molaire d'un solide hydraté
Quelle est la masse molaire du sulfate de cuivre pentahydraté $\ce{CuSO4,5 H2O}$ ?
 - [ ] $\pu{159,6 g*mol-1}$
- [x] $\pu{249,6 g*mol-1}$
- [ ] $\pu{177,6 mol*g-1}$
> $M(\ce{Cu})=\pu{63,5 g* mol-1}$, $M(\ce{S})=\pu{32,1 g*mol-1}$
## Liquide physio
- [ ] $\pu{159,6 g*mol-1}$
- [x] $\pu{249,6 g*mol-1}$
- [ ] $\pu{177,6 mol*g-1}$
> $M(\ce{Cu})=\pu{63,5 g* mol-1}$, $M(\ce{S})=\pu{32,1 g*mol-1}$
## Liquide physio
 Pour créer du liquide physiologique, on dissout 0,45 g de sel (NaCl) dans 50 mL d’eau distillée.
Pour créer du liquide physiologique, on dissout 0,45 g de sel (NaCl) dans 50 mL d’eau distillée.
Quelle est la concentration en sel du liquide physio ?
- [ ] $\pu{11 L*g-1}$ - [ ] $\pu{90 g*L-1}$ - [x] $\pu{9,0 g*L-1}$ - [ ] $\pu{111 L*g-1}$ - [ ] $\pu{22,5 g*L-1}$
 La couronne est-elle :
>
La couronne est-elle :
> - $\rho_\ce{Au} = \pu{19,3 g*cm-3}$
- $\rho_\ce{Ag} = \pu{10,5 g*cm-3}$
- $\rho_\ce{Fe} = \pu{7,9 g*cm-3}$
 - [ ] $\pu{45 g*mol-1}$
- [x] $\pu{46 g*mol-1}$
- [ ] $\pu{45 mol*g-1}$
- [ ] $\pu{46 mol*g-1}$
## Masse molaire d'un solide hydraté
Quelle est la masse molaire du sulfate de cuivre pentahydraté $\ce{CuSO4,5 H2O}$ ?
- [ ] $\pu{45 g*mol-1}$
- [x] $\pu{46 g*mol-1}$
- [ ] $\pu{45 mol*g-1}$
- [ ] $\pu{46 mol*g-1}$
## Masse molaire d'un solide hydraté
Quelle est la masse molaire du sulfate de cuivre pentahydraté $\ce{CuSO4,5 H2O}$ ? - [ ] $\pu{159,6 g*mol-1}$
- [x] $\pu{249,6 g*mol-1}$
- [ ] $\pu{177,6 mol*g-1}$
> $M(\ce{Cu})=\pu{63,5 g* mol-1}$, $M(\ce{S})=\pu{32,1 g*mol-1}$
## Liquide physio
- [ ] $\pu{159,6 g*mol-1}$
- [x] $\pu{249,6 g*mol-1}$
- [ ] $\pu{177,6 mol*g-1}$
> $M(\ce{Cu})=\pu{63,5 g* mol-1}$, $M(\ce{S})=\pu{32,1 g*mol-1}$
## Liquide physio
 Pour créer du liquide physiologique, on dissout 0,45 g de sel (NaCl) dans 50 mL d’eau distillée.
Pour créer du liquide physiologique, on dissout 0,45 g de sel (NaCl) dans 50 mL d’eau distillée.Quelle est la concentration en sel du liquide physio ?
- [ ] $\pu{11 L*g-1}$ - [ ] $\pu{90 g*L-1}$ - [x] $\pu{9,0 g*L-1}$ - [ ] $\pu{111 L*g-1}$ - [ ] $\pu{22,5 g*L-1}$
Déterminer une quantité de matière
Quiz
---
primary_color: steelblue
secondary_color: "#f2f2f2"
text_color: black
shuffle_questions: false
---
## Diamant
---
shuffle_answers: false
---
Combien un diamant de 0,15 carat contient-il de moles de carbone ?
 > Donnée : 1 carat = 0,20 g
- [ ] sûrement beaucoup
- [ ] quelques unes
- [ ] environ 3,0 mol
- [x] environ 2,5 mmol
## Dune du Pilat
La dune du Pilat compte-t-elle plus de grains de sable qu'un diamant d'1 mm3 compte d'atomes ?
> Donnée : 1 carat = 0,20 g
- [ ] sûrement beaucoup
- [ ] quelques unes
- [ ] environ 3,0 mol
- [x] environ 2,5 mmol
## Dune du Pilat
La dune du Pilat compte-t-elle plus de grains de sable qu'un diamant d'1 mm3 compte d'atomes ?
 > Données :
> Données :
volume de la dune : 55 millions de m3
densité du diamant : 3,51.
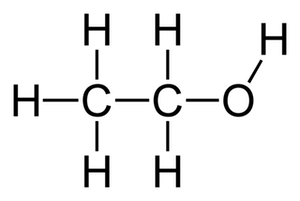
on prendra des grains de sable d'1 mm3 environ. - [ ] oui - [x] non > Et combien de temps passerait-on à compter les grains de sable de la dune ? - [ ] jaune > Bravo ## Éthanol Combien de mol d’éthanol sont contenues dans 5,0 mL d'éthanol pur ? > Données :
> Données :
masse volumique de l'éthanol : $\rho=\pu{7,9E2 kg * m-3}$
$\text{M(O)} = \pu{16 g * mol-1}$ - [x] 87 mmol - [ ] 87 mol - [ ] Autre réponse ## Liquide physio (le retour) Pour créer du liquide physiologique, on dissout 0,90 g de sel (NaCl) dans 100 mL d’eau distillée.
Pour créer du liquide physiologique, on dissout 0,90 g de sel (NaCl) dans 100 mL d’eau distillée.
Quelle est la concentration en quantité de matière en ions chlorures $[\text{Cl}^{-}]$ du liquide physiologique ? > Données :
M(Na) = 23,0 g.mol-1
M(Cl) = 35,5 g.mol-1
On fera l'hypothèse que le $\ce{NaCl (s)}$ se dissout totalement dans l'eau selon l'équation $\ce{NaCl (s) -> Na+ (aq) + Cl- (aq)}$ - [ ] $\pu{25 mmol*L-1}$ - [ ] $\pu{1,5 L*mol-1}$ - [x] $\pu{0,15 mol*L-1}$ - [ ] $\pu{0,25 L*mol-1}$
 > Donnée : 1 carat = 0,20 g
- [ ] sûrement beaucoup
- [ ] quelques unes
- [ ] environ 3,0 mol
- [x] environ 2,5 mmol
## Dune du Pilat
La dune du Pilat compte-t-elle plus de grains de sable qu'un diamant d'1 mm3 compte d'atomes ?
> Donnée : 1 carat = 0,20 g
- [ ] sûrement beaucoup
- [ ] quelques unes
- [ ] environ 3,0 mol
- [x] environ 2,5 mmol
## Dune du Pilat
La dune du Pilat compte-t-elle plus de grains de sable qu'un diamant d'1 mm3 compte d'atomes ?
 > Données :
> Données : volume de la dune : 55 millions de m3
densité du diamant : 3,51.
on prendra des grains de sable d'1 mm3 environ. - [ ] oui - [x] non > Et combien de temps passerait-on à compter les grains de sable de la dune ? - [ ] jaune > Bravo ## Éthanol Combien de mol d’éthanol sont contenues dans 5,0 mL d'éthanol pur ?
 > Données :
> Données :masse volumique de l'éthanol : $\rho=\pu{7,9E2 kg * m-3}$
$\text{M(O)} = \pu{16 g * mol-1}$ - [x] 87 mmol - [ ] 87 mol - [ ] Autre réponse ## Liquide physio (le retour)
 Pour créer du liquide physiologique, on dissout 0,90 g de sel (NaCl) dans 100 mL d’eau distillée.
Pour créer du liquide physiologique, on dissout 0,90 g de sel (NaCl) dans 100 mL d’eau distillée.Quelle est la concentration en quantité de matière en ions chlorures $[\text{Cl}^{-}]$ du liquide physiologique ? > Données :
M(Na) = 23,0 g.mol-1
M(Cl) = 35,5 g.mol-1
On fera l'hypothèse que le $\ce{NaCl (s)}$ se dissout totalement dans l'eau selon l'équation $\ce{NaCl (s) -> Na+ (aq) + Cl- (aq)}$ - [ ] $\pu{25 mmol*L-1}$ - [ ] $\pu{1,5 L*mol-1}$ - [x] $\pu{0,15 mol*L-1}$ - [ ] $\pu{0,25 L*mol-1}$
Documents et autres
| Protocoles | Dissolution |
|---|---|
| Dilution + Rappels théoriques | |
| Manipulations | Tutos sur l'utilisation de la pipette + propipette et de la fiole jaugée |
| TP | Feu tricolore |
| Dissolution d'un solide ionique | |
| Pictogrammes | Pictogrammes internationaux de danger |